时间:2025-06-26 04:09:09
1、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
[? ]
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.溶液中的c(CH3COOH)
D.溶液中的c(OH-)
参考答案:D
本题解析:
本题难度:一般
2、填空题 下列说法是否正确?为什么?
(1)NH3在碱性溶液中比在纯水的溶解度大。
(2)氯化钠和醋酸铵的pH都接近于7,因此它们都没有发生水解。
参考答案:(1)不正确。NH3溶于水,存在溶解平衡、化学平衡和电离平衡:
NH3 (g) NH3 (aq);NH3 + H2O
NH3 (aq);NH3 + H2O NH3·H2O
NH3·H2O NH4+ + OH-
NH4+ + OH-
碱性溶液中c (OH-)较大,会促使上述平衡逆向移动,使得NH3的溶解度下降。
(2)不正确。氯化钠pH接近于7,是因为Na+、Cl-不影响水的电离;没有发生水解。而醋酸铵的pH接近于7,是因为CH3COO-、NH4+都发生了水解,只是水解程度几乎相同。
本题解析:(1)不正确,因为NH3溶于水,存在溶解平衡、化学平衡和电离平衡:
NH3 (g) NH3 (aq);NH3 + H2O
NH3 (aq);NH3 + H2O NH3·H2O
NH3·H2O NH4+ + OH-
NH4+ + OH-
碱性溶液中c (OH-)较大,会促使上述平衡逆向移动,使得NH3的溶解度下降。
(2)不正确,氯化钠pH接近于7,是因为Na+、Cl-不影响水的电离;没有发生水解。而醋酸铵的pH接近于7,是因为CH3COO-、NH4+都发生了水解,但二者的水解程度几乎相同,所以溶液显中性。
本题难度:一般
3、选择题 已知某温度时CH3COOH的电离平衡常数为K。该温度下向20mL 0.1mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是 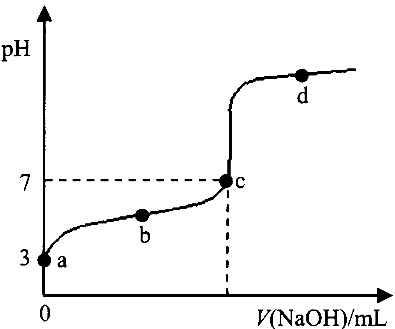
[? ]
A.a点表示的溶液中c (CH3COO-)=10-3 mol·L-1
B.b点表示的溶液中c (CH3COO-)> c (Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中 均等于K
均等于K
参考答案:C
本题解析:
本题难度:一般
4、填空题 (4分)判断下列说法是否正确(正确的在括号内打“√”错误的打“×”)
①中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠少于醋酸;( )
②将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的 ;( )
;( )
③如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍;( )
④物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO3-4量相同。( )
参考答案:?× ?× ?× ?×
本题解析:
试题解析:?中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠一样多,故错误;?将氢氧化钠溶液和氨水各稀释一倍,氢氧化钠 c(OH-)减少到原来的一半,但是随着溶液变稀,氨水的电离度增大,因此稀释后的氨水c(OH-)大于原来的一半,故错误;?如果盐酸的物质的量浓度是醋酸的二倍,由于醋酸是弱酸,则盐酸的c(H+)与醋酸c(H+)之比大于2,故错误;?磷酸钠是强电解质,在溶液中完全电离,磷酸是弱电解质,在溶液中微弱电离,磷酸钠溶液中磷酸根浓度大,故错误。
考点:弱电解质的电离
本题难度:一般
5、选择题 已知在含氧酸中只有H原子与O原子相连时,才能在水溶液中电离出H+。次磷酸与足量的氢氧化钠溶液 反应的产物为NaH2PO2,又知浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱。据此判断下列说法中正确的是
[? ]
A.次磷酸是二元弱酸,在水中的电离方程式为H3PO2 H++H2PO2-
H++H2PO2-
B.次磷酸的结构中,只有一个H原子与O原子直接相连
C.次磷酸是一元弱酸,在水中的电离方程式为H3PO2 H++H2PO2-
H++H2PO2-
D.0. 1mol/L次磷酸可与等体积的0.2mol/L氢氧化钠溶液完全中和
参考答案:BC
本题解析:
本题难度:一般