时间:2017-07-18 02:34:05
1、选择题 下列各元素的氧化物中,既能与盐酸反应,又能够与?NaOH?溶液反应的是( )
A.元素X:它的原子中M层比L层少2个电子
B.元素Y:它的二价阳离子核外电子总数与氩原子相同
C.元素Z:位于元素周期表中的第三周期,ⅢA族
D.元素W:它的焰色反应颜色呈浅紫色
2、选择题 经X射线研究证明:PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成。下列关于PCl5的推断正确的是(?)
A? PCl5固体是分子晶体
B? PCl5固体有良好的导电性
C? PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D? PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
3、选择题 据中国石油网报道,加利福尼亚大学的研究人员发现了世界上最强的酸,这种强酸的化学式是
CB11H6Cl6,结构式如图所示,由11个硼原子和1个碳原子排列成20面体。该强酸中原子间的化学键类型是 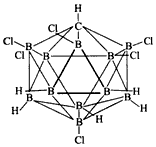
[? ]
A.只有共价键
B.只有离子键
C.既有离子键又有共价键
D.是一种介于共价键与离子键之间的一种键
4、选择题 下列关于粒子结构的描述正确的是
A.NF3和BF3是中心原子杂化类型相同的极性分子
B.CH2Cl2和C2H4是空间构型不同的非极性分子
C.在SiO2晶体中,Si原子与Si—O键数目比为1︰2
D.CF4和CO2是含极性键的非极性分子
5、填空题 a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式: ①c__________;②d__________;③e__________;④a__________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:_______________________________。