时间:2017-07-10 19:03:35
1、选择题 下列说法不正确的是(?)
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动
NH3·H2O+H+达到平衡后,升高温度平衡正向移动
B.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,该现象不足以说明Ksp(BaSO4)与Ksp(BaCO3)大小关系。
C.明矾水解生成Al(OH)3胶体,可用作净水剂
D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0
参考答案:D
本题解析:根据图1所示的反应过程,A+B→X的△H应该是大于0,X→C的△H应该是小于0,错误。
本题难度:一般
2、选择题 理论上不能设计为原电池的化学反应是( )
A.CH4+2O2
? |
? |
参考答案:A、该反应属于自发的氧化还原反应,所以能设计成原电池,故A错误;
B、该反应属于复分解反应,不是氧化还原反应,所以不能设计成原电池,故B正确;
C、该反应属于自发的氧化还原反应,所以能设计成原电池,故C错误;
D、该反应属于自发的氧化还原反应,所以能设计成原电池,故D错误;
故选B.
本题解析:
本题难度:简单
3、填空题 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
参考答案: (1)电解质溶液 抑制硫酸亚铁的水解
(2)V+2H++e- VO2++H2O V3++e-
VO2++H2O V3++e- V2+ 升高
V2+ 升高
(3)acd (4)H+
本题解析: (1)传统的铜锌原电池中,锌与酸反应生成氢气,故硫酸为电解质溶液;硫酸亚铁容易水解,且水解显酸性,加入少量硫酸,可以抑制其水解变质。(2)正极反应是还原反应,由电池总反应可知放电时的正极反应为V+2H++e- VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。(3)充电时阳极反应式为VO2++H2O-e-
VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。(3)充电时阳极反应式为VO2++H2O-e- V+2H+,故充电完毕的正极电解液为V溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项acd。(4)充电和放电过程中,正极电解液与负极电解液不能混合,起平衡电荷作用的是加入的酸,故H+可以通过隔膜。
V+2H+,故充电完毕的正极电解液为V溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项acd。(4)充电和放电过程中,正极电解液与负极电解液不能混合,起平衡电荷作用的是加入的酸,故H+可以通过隔膜。
考点:燃料电池
本题难度:一般
4、选择题 下列各装置中,能构成原电池的是(?)

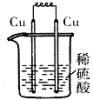
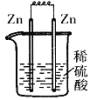
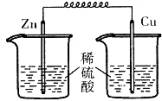
A? B? C? D
参考答案:A
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连且插入电解质溶液中,所以A正确。B和C中电极相同,D中没有形成完整的闭合回路。答案是A。
本题难度:简单
5、选择题 如图所示的装置中,观察到电流计指针发生偏转,M棒变粗,N棒变细,由此判断如下M、N、P(溶液),其中可以成立的是( )
A.M-AgN-ZnP-AgNO3
B.M-ZnN-CuP-H2SO4
C.M-CuN-FeP-HCl
D.M-FeN-CuP-CuSO4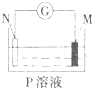
参考答案:A.N(Zn)为负极,正极上银离子得电子,构成原电池,能成立,故A正确;
B.M为负极,且正极生成氢气,与题意不符,故B错误;
C.N(Fe)为负极,但正极上生成氢气,与题意不符,故C错误;
D.M为负极,正极上析出Cu,与题意不符,故D错误;
故选A.
本题解析:
本题难度:一般