时间:2025-06-26 04:00:51
1、计算题 把12.6g的镁铝合金的粉末放入过量盐酸中,得到13.44L气体(标况下)。试计算:
(1)该合金中铝的质量分数
(2)该合金中镁和铝的物质的量之比
参考答案:(1)W(Al) = 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题解析:设合金中镁和铝的物质的量分别为X mol,Y mol,
n(H2)=" 13.44/22.4" =" 0.6" mol
Mg+2H+===Mg2++H2↑
1 mol 1 mol
X mol Xmol
2Al+6H+===2Al3++3H2↑
2 mol ? 3 mol
Y mol 1.5 Y mol
(1)W(Al)= 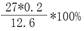 = 42.9%
= 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题难度:简单
2、填空题 以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
参考答案:(1)Fe(或铁)?稀硫酸
(2)冷却结晶?过滤(洗涤干燥)
(3)3.7~4.7
(4)Fe+2Fe3+=3Fe2+
本题解析:以黄铜矿为原料进行炼铜,同时得到副产品绿矾的主要流程如下:反应Ⅰ是将CuFeS2转化为CuSO4和Fe2(SO4)3,并过滤除去SiO2。反应Ⅱ是通过水解反应分离CuSO4和Fe2(SO4)3,根据表中给出的数据可知,Fe3+的氢氧化物从开始沉淀到沉淀完全的pH范围是2.7~3.7,Cu2+的氢氧化物从开始沉淀到沉淀完全的pH范围是4.7~6.7,要想将溶液中的Fe3+完全沉淀且Cu2+不能沉淀,需要调节溶液的pH为3.7~4.7;为了不引入新杂质,可以向溶液中加入CuO调节溶液的pH至3.7~4.7,此时Fe3+完全沉淀;最后过滤,即可得到纯净的CuSO4溶液和Fe(OH)3沉淀。由实验目的知,反应Ⅲ是将CuSO4转化为Cu,所以加入的试剂a是过量的Fe,反应后过滤得到FeSO4溶液和Fe、Cu混合物。反应Ⅳ是从Fe、Cu混合物中得到Cu,所以加入的试剂b是稀硫酸。反应Ⅴ是将Fe2(SO4)3转化为FeSO4溶液,发生反应的离子方程式为:Fe+2Fe3+=3Fe2+。操作X是从FeSO4溶液中得到绿矾,操作方法为:蒸发浓缩、冷却结晶、过滤。
本题难度:一般
3、计算题 已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
参考答案:(1)2.75mol/L
(2) 0
(3)7L< V <11.2L
本题解析:(1)设9.6g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=9.6? 8x/3+10y/3=0.225
解得:x=y=0.0375mol, c(NO3-)= (0.5mol-0.225 mol)/0.4L=2.75mol/L
(亦可根据N原子守恒来求)
(2)设12.8g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L? pH=0
(3)首先判断64g样品中CuS、Cu2S的物质的量皆为0.25mol,分别跟0.5mol硝酸反应时均过量。因此采用极端假设法思考:
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×10/16×22.4L/mol=7L
所以:c中产生气体体积(V)等于7L< V <11.2L。
本题难度:简单
4、填空题 某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有Si O2、A12O3等杂质)提取Fe2O3。操作讨程如下: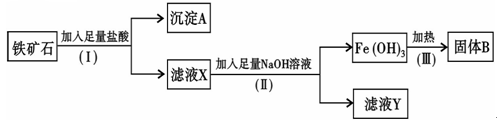
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有? ?(填化学式),固体B是?(填化学式);
?(填化学式),固体B是?(填化学式);
(3)滤液Y中的阴离子除OH-、Cl-外,还有?(填化学式);
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
参考答案:(6分)
(1)过滤?
(2)? SiO2?Fe2O3
(3)A1O2-
(4)Fe3++3OH-? ?Fe(OH)3↓
?Fe(OH)3↓
本题解析:略
本题难度:一般
5、实验题 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe2+具有还原性 | 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ | 溶液变成血红色 |
| 探究Fe2+具有氧化性 | 取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 | 溶液由浅绿色变无色 所发生反应离子方程式为________________ |
参考答案:(1)①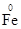
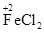
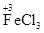 (其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(2)
实验方案
实验现象
取少量0.1 mol·L-1 FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液
加入氯水后,溶液由浅绿色变黄色,再加入少量KSCN溶液后溶液变红色
取少量0.1 mol·L-1 FeCl2溶液,加入锌粒充分反应
加入锌粒后,溶液由浅绿色变无色Fe2++Zn=Fe+Zn2+
本题解析:(1)铁常见的化合价就只有三种:零价、正二价、正三价;金属铁还原三价铁离子成二价铁离子就是一个三种化合价的铁都有的铁的反应方程式;
(2)还原性的检验是用氯水来氧化二价铁离子,氧化性的检验是用多属单质来还原三价铁离子。
本题难度:一般