时间:2025-06-26 04:00:51
1、选择题 坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
A.铁单质只具有还原性,其阳离子只具有氧化性
B.常温下,单质铁与浓硫酸不反应
C.铁元素属于过渡元素,其原子序数为26
D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
参考答案:C
本题解析:略
本题难度:一般
2、填空题 磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4溶液)制备磁材氧化铁的步骤如下: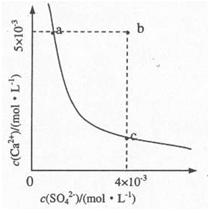
①向下脚料(含大量FeSO4溶液)中加入少量2 mo1·L-1叫H2SO4和铁皮;
②向①中所得溶液中加絮凝剂和水,经过滤除去吸附了杂质的絮凝剂;
③将②所得的滤液浓缩结晶得到晶体A;
④将晶体A溶于水,并加入NH4HCO3,产生CO2气体同时得到FeCO3沉淀和无色溶液C;
⑤将FeCO3沉淀洗涤、烘干并煅烧。(煅烧中的变化为:FeCO3="FeO+CO2↑;?" 4FeO+O2="2" Fe2O3)
据上述信息回答下列问题:
(1)用18.4mo1·L-1的H2SO4配制500mL 2 mo1·L-1H2SO4,所需玻璃仪器除
??mL量筒、玻璃棒、烧杯、500mI。容量瓶外,还需要?。
(2)步骤①中2 mo1·L-1H2SO4和铁皮的作用分别为?。
(3)晶体A的化学式为?,检验溶液C中溶质阳离子的方法是?。
(4)向溶液C中加入CaCl2溶液能得到CaSO4沉淀,常温下KSP(CaSO4)=9x10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。
①a点对应的KSP?c点对应的KSP填“大于”、“小于”或“等于”);
②若由b点变到a点下列措施可行的是??。
A.加入适量CaCl2
B.加入适量BaCl2.
C.加人适量Na2SO4
D.蒸发
参考答案:(1)100,(2分)胶头滴管(1分)?(2)加2mol· 防止Fe
防止Fe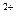 发生水解,(1分)?加铁皮防止Fe
发生水解,(1分)?加铁皮防止Fe 被氧化(1分)?(3)
被氧化(1分)?(3) ,(1分)取该溶液少许加入氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液的阳离子为
,(1分)取该溶液少许加入氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液的阳离子为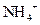 。(3分)?(4)等于,(2分)? A、B。(2分)
。(3分)?(4)等于,(2分)? A、B。(2分)
本题解析:略
本题难度:一般
3、计算题 (10分)使250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸跟铁屑充分反应。计算:
(1)此硫酸中H2SO4的物质的量浓度。
(2)生成H2的体积(标准状况)。
(3)将生成的硫酸亚铁配制成400? mL溶液,此溶液中硫酸亚铁的物质的量浓度是多少?
参考答案:(1)2.75 mol·L-1
(2)15.4 L
(3)1.73 mol·L-1
本题解析:(1)c= ="2.75" mol·L-1。
="2.75" mol·L-1。
(2)n(H2SO4)="2.75" mol·L-1×0.250 L="0.688" mol
根据Fe+H2SO4====FeSO4+H2↑即知生成的氢气也为0.688 mol,在标准状况下的体积为0.688 mol×22.4 L·mol-1="15.4" L。
(3)从(2)中可以求出硫酸亚铁也是0.688 mol,则c(FeSO4)= ="1.73" mol·L-1。
="1.73" mol·L-1。
本题难度:简单
4、实验题 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实
验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图: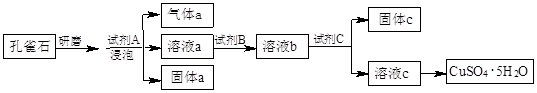
(1)研磨孔雀石的目的是?。浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是??(填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用??(填序号):
A.酸性KMnO4溶液? B.双氧水? C.浓硝酸? D.氯水
相应的离子方程式为:?。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用?(填序号):
A.稀硫酸? B.NaOH溶液? C.氨水? D.CuO
固体C的化学式为?。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,则该反应的化学方程式为?。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液调节至pH=?。
参考答案:(1)(共4分)增大固体表面积(1分),以增大反应速率(1分)[类似意思均可]?
SiO2(2分)
(2)(共4分)B(2分)? 2Fe2++2H++H2O2=2Fe3++2H2O(2分)(未配平1分,写为化学方程式2FeSO4 + H2SO4 + H2O2 = Fe2(SO4)3 + 2H2O且正确1分)
(3)(共4分)D(2分)? Fe(OH)3(2分)
(4)(共3分)3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
(5)(共2分)2
本题解析:(1)研磨孔雀石的目的是为了酸溶速率更快,所以答案为“增大固体接触面积,加快反应速率”,酸溶过程中不溶的固体为杂质SiO2。
(2)把Fe2+转化为Fe3+ 应该加入氧化剂,且不能带入杂质离子,所以用双氧水,选B。相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O。
(3)因为目标产品是CuSO4·5H2O晶体,所以调节pH值使铁离子沉淀应选用的试剂不能带入杂质离子,所以选用固体CuO,所以沉淀物c为Fe(OH)3 和过量的CuO。
(4)碱式碳酸铜中通入氨气后有铜单质生成,说明铜被还原,NH3做还原剂。因为1mol氨气还原得到1.5mol铜单质,根据铜+2→0价,可知转移电子3mol,得失电子守恒,所以NH3失去电子也为3mol,所以可推测得NH3被氧化为了N2,所以可以得知其他产物还有CO2、H2O。所以列出反应物NH3+ Cu2(OH)2 CO3→Cu+ N2+CO2+H2O,然后根据氧化还原反应方程式配平得:3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2 。
6Cu + 3CO2 + 9H2O +2 N2 。
(5)根据Fe(OH)3溶解平衡Fe(OH)3 (s) ?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
本题难度:一般
5、填空题 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。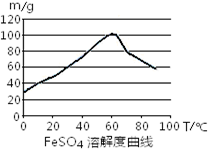
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为?。若要提高FeSO4生成速率,采取下列措施中正确的是?。
A.使用浓硫酸与铁屑反应?
B.使用磨细的铁粉反应
C.控制温度在50~70℃?
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O?
4Fe3++2H2O?
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是?。
A.控制稀硫酸的浓度不能太高?
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1?
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行?、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: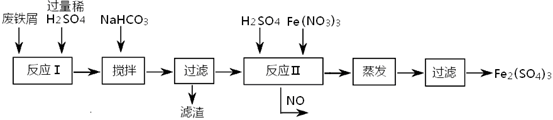
①加入NaHCO3并搅拌,将混合液pH调控至?范围内,使杂质沉淀过滤除去。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
参考答案:(1)①? Fe+2H+=Fe2++H2↑? B、C?②? A、C?③?过滤?(2)①? 6.7~7.5
②? 3Fe2++NO3-+4H+ =3Fe3++NO↑+2H2O?③?节约Fe(NO3)3、防止NO污染? 3 : 4?
(3)2Fe3++3S2-? ="2" FeS↓+S
本题解析:(1)铁和氢离子发生置换反应制备硫酸亚铁,可以使用铁粉增大接触面积,加快速率,B正确;但是不能用浓硫酸,铁在常温条件下遇浓硫酸钝化,A错误;硫酸亚铁在60℃时溶解度高,所以选择温度在50~70℃,C正确,D错误。减少Fe2+被氧化,控制硫酸浓度,减少H+浓度,平衡逆向移动,A正确,B、稀释浓硫酸应该把硫酸向水中加,并不断搅拌,错误;C、铁过量可以防止Fe2+被氧化,正确;D、加入Fe3+将会增加Fe3+浓度,错误。反应结束后,过滤除去过量的铁,再降低温度,硫酸亚铁的溶解度减小,析出晶体。(2)废铁屑加入过量的稀硫酸,铁和铝溶解,铜不溶,再加NaHCO3调PH至6.7~7.5之间,Al3+、Cu2+沉淀,再过滤,加入氧化剂把Fe2+氧化,蒸发结晶得产物。为了节约Fe(NO3)3、防止NO污染,可以利用氧气和NO按照3:4反应生成硝酸做氧化剂。
本题难度:困难