时间:2025-06-26 04:00:51
1、计算题 铁、锌合金8.5g溶于稀H2SO4中,充分反应后制得0.300gH2,求合金中Fe,Zn的含量分别为多少克。?
2、简答题 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁“.请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁“.实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).填写下列空白:
(1)实验进行时试管A中应加入的试剂是______;烧瓶B的作用是______;烧瓶C的作用是______;在试管D中收集得到的是______.
(2)实验时,U型管G中应加入的试剂是______;长颈漏斗H中应加入______.
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)______.
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是______.
(5)试管E中发生反应的化学方程式是______.
(6)为了安全,在E管中的反应发生前,在F出口处必须______;E管中的反应开始后,在F出口处应______.
3、选择题 下列物质中,常用来制造油漆和颜料的是
[? ]
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe(OH)3
4、选择题 把铁粉投入氯化铜和氯化铁的混合溶液中,充分反应后,下列说法中正确的是
A.若无铜析出,则溶液中有Cu2+、Fe2+,可能有Fe3+
B.若有铜析出,则溶液中含有Fe2+,没有Cu2+和Fe3+
C.若铁有剩余,则溶液中含有Fe2+,没有Cu2+和Fe3+
D.若铁无剩余,则溶液中含有Fe2+,无Fe3+,可能含有Cu2+
5、填空题 氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
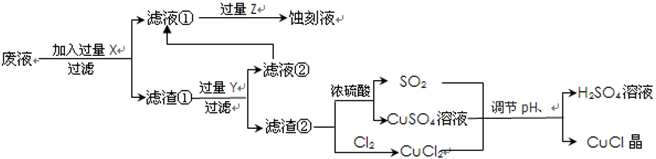 根据以上信息回答下列问题:
根据以上信息回答下列问题:| ? | 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |