时间:2025-06-26 00:36:34
1、选择题 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+
C.两烧杯中的pH值均增大
D.产生的气泡速率甲比乙慢
参考答案:C
本题解析:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;B.乙中不构成原电池,铜片不是电极,故B错误;C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C正确;D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;故选C.
本题难度:一般
2、选择题 下列判断中正确的是
A.烧杯a中的溶液pH升高
B.锌是化学电源的正极
C.烧杯a中发生的反应为2H++2e-=H2↑
D.盐桥中的阳离子向铁电极移动
参考答案:AD
本题解析:锌的金属性强于铁的,根据装置图可知,该装置是原电池。其中锌是负极,铁是正极。由于正极通入氧气,所以属于锌的吸氧腐蚀,A正确,B、C不正确。原电池中阳离子向正极移动,则D正确,答案选AD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,有利于培养学生逻辑推理能力,以及灵活运用基础知识解决实际问题的能力。该题的关键是掌握原电池原理中正负极的判断、溶液中离子的移动以及电极反应式的书写等。
本题难度:简单
3、选择题 下图两个装置中,液体体积均为400 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得两池均有0.02 mol电子转移,若忽略溶液体积的变化,下列叙述正确的是 ?
?
A.②装置中硫酸根离子移向铜极
B.①中阴极质量增加,②中正极质量减小
C.产生气体的物质的量: ①=②
D.溶液的pH变化:①减小,②增大
参考答案:
本题解析:A项,②是原电池,锌作负极失电子生成Zn2+,锌极显正电性,带负电的硫酸根离子会移此极;B项,①中阴极反应式:Cu2++2e-=Cu,显然增加,②中正极反应式2H++2e-=H2↑,显然该极质量不变,故B项错误;C项,据①中电极反应式:阴极:Cu2++? 2e- ="?"
0.2mol? 0.4 mol
Cu,0.02mol小于0.4mol,即Cu2+没有放电完,
阳极:4OH-- 4e-= 2H2O + O2↑,?据②中电极反应式:正极:2H+?+ 2e-= H2↑,故两
0.02 mol? 0.005 mol? 0.02mol 0.01mol
装置中产生气体的物质的量不相等;D项,据①中总反应式:2Cu2++2H2O 2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
答案:D
本题难度:一般
4、选择题 如图所示,其中甲池的总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O下列说法正确的是( )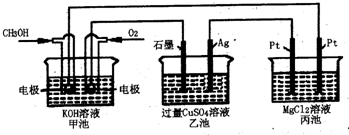
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗560mL(标准状况下)O2,此时丙池中理论上最多产生2.9g固体
参考答案:A、甲池是燃料电池,乙池和丙池有外接电源属于电解池,所以甲池是把化学能转变为电能的装置,乙池和丙池是把电能转变为化学能的装置,故A错误.
B、燃料电池中,投放燃料的电极是负极,负极上燃料失去电子放电氧化反应,电极反应式为CH3OH-6e-+8HO-=CO32-+6H2O,故B错误.
C、甲池中投放甲醇的电极是负极,投放氧气的电极是正极,所以乙池中石墨是阳极,银极是阴极,电解时,石墨极上析出氧气,银极上析出铜,所以要想使CuSO4溶液恢复到原浓度应加入氧化物而不是氢氧化铜,故C错误.
D、甲池中消耗560mL(标准状况下)O2,转移电子0.1mol,根据转移电子守恒知,丙池中生成0.05mol氢气,同时生成0.1mol氢氧根离子,氢氧根离子和镁离子生成氢氧化镁沉淀,所以氢氧化镁沉淀的物质的量是0.05mol,氢氧化镁沉淀的质量=0.05mol×58g/mol=2.9g,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是
A.在原电池中,物质在负极发生氧化反应
B.在原电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项A正确,其余选项都是错误的,答案选A。
考点:考查原电池的有关判断。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般