时间:2025-06-26 00:36:34
1、选择题 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
A.锌是正极,MnO2是负极
B.锌是负极,MnO2是正极
C.锌是正极,石墨棒是负极
D.锌是负极,石墨棒是正极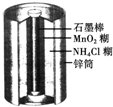
2、填空题 (3分)用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是?,正极的电极反应式是?。
3、实验题 (1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
4、选择题 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
C.正极上发生的反应为:O2+4e-+2H2O===4OH-
D.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
5、填空题 (10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:?
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是?
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是?
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |