时间:2025-06-26 00:36:34
1、选择题 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
A.锌是正极,MnO2是负极
B.锌是负极,MnO2是正极
C.锌是正极,石墨棒是负极
D.锌是负极,石墨棒是正极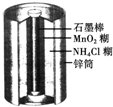
参考答案:普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2,锌是负极,石墨棒是正极.
故选D.
本题解析:
本题难度:一般
2、填空题 (3分)用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是?,正极的电极反应式是?。
参考答案:略
本题解析:略
本题难度:简单
3、实验题 (1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
参考答案:(1)NO; 4.8g (每空2分)(2)H2O2+2H++2e-=2H2O ;增大(每空2分)
(3)B(OH)3+H2O B(OH)4- + H+ ; N2H5+ +H2O
B(OH)4- + H+ ; N2H5+ +H2O N2H62+ + OH-
N2H62+ + OH-
本题解析:略
本题难度:一般
4、选择题 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
C.正极上发生的反应为:O2+4e-+2H2O===4OH-
D.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
参考答案:B
本题解析:原电池中阳离子向正极移动,故H+向正极移动,A错;燃料电池的总反应是燃料和氧气的反应,B对;在酸性燃料电池中不可能生成OH-,C错;正极上发生的反应为:O2+4e-+4H+===2H2O,从该反应看出有0.4 mol电子转移时消耗氧气的物质的量为0.1mol,标准状况下体积为2.24 L,D错。
考点:燃料电池的工作原理和电子转移的计算。
本题难度:一般
5、填空题 (10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:?
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是?
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是?
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
参考答案:(1)N2(g) + 3H2(g)  2NH3(g);△H=-93 KJ·mol-1(2分)
2NH3(g);△H=-93 KJ·mol-1(2分)
(2)②⑤(选对1个1分,错选扣分,不出现负分,共2分)
(3)0.008 mol·L-1·min-1(1分)? 0.1(1分)?逆反应(1分)
(4)CaSO4+(NH4)2CO3= (NH4)2SO4 +CaCO3↓(2分)
因为Ksp(CaSO4)=7.10×10-5>Ksp(CaCO3)=4.96×10-9(1分)
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,即436KJ·mol-1×3+945 KJ·mol-1-391 KJ·mol-1×6=-93 KJ·mol-1,所以热化学方程式为N2(g) + 3H2(g)  2NH3(g);△H=-93 KJ·mol-1。
2NH3(g);△H=-93 KJ·mol-1。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。①中反应速率的方向是相同的,不正确。
②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以③不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,④不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以⑤可以说明。答案选②⑤。
(3)5min时氨气的浓度是0.08mol/L,所以氨气的反应速率是0.08mol/L÷5min=0.016mol/(L·min)。因为速率之比是相应的化学计量数之比,所以氮气的反应速率是
0.008mol/(L·min)。平衡时氨气的浓度是0.20mol/L,则消耗氮气和氢气的浓度分别是0.1mol/L、0.3mol/L。则平衡时氮气和氢气的浓度分别是0.5mol/L-0.1mol/L=0.4mol/L、1.3mol/L-0.3mol/L=1.0mol/L,所以平衡常数是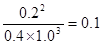 。若往平衡体系中加入H2、N2和NH3各2mol,则此时H2、N2和NH3的浓度分别为2.0mol/L、1.4mol/L、1.2mol/L,所以
。若往平衡体系中加入H2、N2和NH3各2mol,则此时H2、N2和NH3的浓度分别为2.0mol/L、1.4mol/L、1.2mol/L,所以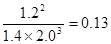 >0.1,所以平衡向逆反应方向移动。
>0.1,所以平衡向逆反应方向移动。
(4)碳酸钙比硫酸钙的溶解度小,即Ksp(CaSO4)=7.10×10-5>Ksp(CaCO3)=4.96×10-9,所以反应的方程式为CaSO4+(NH4)2CO3= (NH4)2SO4 +CaCO3↓。
本题难度:一般