时间:2025-06-25 23:43:27
1、填空题 (10分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)工业上一般采用CO和H2反应合成可再生能源甲醇。反应如下:
CO(g) + 2H2(g)  CH3OH(g) ΔH= -90.1KJ·mol-1
CH3OH(g) ΔH= -90.1KJ·mol-1
在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:(前6min没有改变条件)
| | 2min | 4min | 6min | 8min | … |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |

参考答案:(10分,每空2分) (1)①x=0.14 ②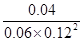 ③加1 mol氢气 ④ 不是
③加1 mol氢气 ④ 不是
(2)2NO(g)+2H2(g)=N2(g)+2H2O(g) ΔH="-665" kJ·mol-1
本题解析:(1)①根据表中数据可知2min至4min时消耗CO是0.01mol/L×10L=0.1mol,则根据方程式可知同时消耗氢气是0.2mol,所以x=0.02+0.12=0.14。
②根据表中数据可知反应进行到4min时达到平衡状态,此时CO、氢气、甲醇的浓度分别是0.006mol/L、0.012mol/L、0.004mol/L,实验平衡常数K=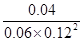 。
。
③6min时CO浓度减小,氢气和甲醇浓度增加,且CO浓度减小0.01mol/L,氢气浓度增加0.08mol/L,所以若6min~8min只改变了某一条件,所改变的具体条件是加1mol氢气。
④第8min时,CO、氢气和甲醇的浓度分别是0.05mol/L、0.20mol/L、0.05mol/L,则此时浓度商=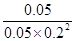 ≠
≠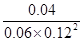 ,因此不是平衡状态。
,因此不是平衡状态。
(2)由于反应热等于断键吸收的能量与形成化学键说放出的能量的差值,所以根据关系图可知该反应的反应热=2×630 kJ·mol-1+2×436 kJ·mol-1—945 kJ·mol-1—4×436 kJ·mol-1=—665 kJ·mol-1,所以热化学方程式为2NO(g)+2H2(g)=N2(g)+2H2O(g) ΔH="-665" kJ·mol-1。
考点:考查可逆反应与反应热的有关计算
本题难度:一般
2、选择题 Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):a X( ?)+2Y( ?) 3Z(g) ,此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是
3Z(g) ,此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是 
[? ]
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y有一种为气体,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y 的体积分数变大
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X、Y有一种为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小
参考答案:D
本题解析:
本题难度:一般
3、选择题 本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是?(? )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
参考答案:C
本题解析:略
本题难度:简单
4、选择题 用于净化汽车尾气的反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
[? ]
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570 K时该反应正向进行的程度很大,故使用催化剂并无实际意义
参考答案:C
本题解析:
本题难度:一般
5、填空题 25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。 
(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K=
___________。从反应开始到达第一次平衡时的平均速率v(A)为________________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______________________________。
(3)下图表示此反应的反应速率v和时间t的关系图 
各阶段的平衡常数如下表所示
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________;K1、K2、K3、K4之间的关系为:_________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是_________。
参考答案:(1)A+2B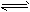 2C;
2C;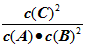 ;0.05mol·L-1·min-1
;0.05mol·L-1·min-1
(2)加压
(3)升温;减压;K1>K2=K3=K4;t2~t3
本题解析:
本题难度:困难