时间:2025-06-25 23:43:27
1、选择题 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)  2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体的总物质的量
C.气体的平均分子量 D.v(B)=3V(D)
参考答案:C
本题解析:
首先要确定可逆反应的特点:反应前后气体总体积不变,反应物A为固体,再确认外界条件为恒温恒容条件。A、反应前后,气体的物质的量不发生变化,体积恒定,反应自开始到平衡,压强都是定值,故A不合题意;
B、该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,气体的总物质的量始终不变,故B不合题意;
C、气体的平均分子量数值上等于其平均摩尔质量=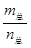 ,A是固体,根据质量守恒,随着反应进行,气体的质量在增加,当气体的总质量不发生变化时,气体的平均分子量也不再变化,说明到达平衡状态,故C正确;
,A是固体,根据质量守恒,随着反应进行,气体的质量在增加,当气体的总质量不发生变化时,气体的平均分子量也不再变化,说明到达平衡状态,故C正确;
D、任意时刻都有v(B)=3V(D),所以D不合题意。
考点:化学平衡状态的标志
点评:本题考查了化学平衡状态的标志,难度不大。在做此类题目时,要确定可逆反应的特点以及外界条件的限制。
本题难度:一般
2、选择题 某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2后改变互不相同的某一条件反应速率随时间变化的关 系图,t3~t4阶段使用了催化剂。下列说法错误的是 
[? ]
A.若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02 mol
D.该化学反应的表达式为:3A(g) B(g)+2C(g)
B(g)+2C(g)
参考答案:C
本题解析:
本题难度:一般
3、填空题 在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表所示
2NO2(g)体系中,n(NO)随时间的变化如下表所示
(1)写出该反应的平衡常数表达式:K=____________。
(2)如图中表示NO2的变化的曲线是_____。用O2表示从0~2s内该反应的平均速率v=________。 
(3)下列能说明该反应已达到平衡状态的是________。
A.v(NO2)=2u(O2) B.容器内压强保持不变 C.v逆(NO)= 2v正(O2) D.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1mol NO2,热量变化为56.4 kJ。根据题目信息,该反应的热化学方程式为____________________。
(5)为使该反应的反应速度增大,且平衡向正反方向移动的是________。
A.及时分离除NO2气体 B适当升高温度 C.增大O2的浓度 D.选择高效催化剂
参考答案:(1)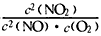 (2)b;1. 5×10-3mol·L-1·s-1
(2)b;1. 5×10-3mol·L-1·s-1
(3)BC
(4)2NO(g)+O2(g)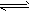 2NO2(g) △H=-112. 8 kJ/mol
2NO2(g) △H=-112. 8 kJ/mol
(5)C
本题解析:
本题难度:一般
4、选择题 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
| 选项 | x | y A 温度 容器内混合气体的密度 B CO的物质的量 CO2与CO的物质的量之比 C SO2的浓度 平衡常数K D MgSO4的质量(忽略体积) CO的转化率 |

参考答案:该反应为正方向体积增加且吸热.
A、升高温度,平衡正向移动,气体的质量增加,密度增大,故A正确;
B、增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故B错误;
C、平衡常数只与温度有关,浓度变化平衡常数不变,故C错误;
D、因MgSO4为固体,增加其量,对CO的转化率无影响,故D错误;
故选A.
本题解析:
本题难度:简单
5、填空题 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)=2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“ 减小” 或“不变”)
① 降低温度:
②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积:
参考答案:(1)3X+Y 2Z(不写可逆符号不给分)
2Z(不写可逆符号不给分)
(2)0.075mol?L-1?min-1
(3)A
(4)①减小②增大③减小
本题解析:(1)由图可知,X、Y是反应物,物质的量分别减少0.3mol、0.1mol,Z是生成物,物质的量增加0.2mol,则方程式中X、Y、Z的物质的量比是3:1:2,所以该反应的化学方程式为:3X+Y 2Z
2Z
(2)X的浓度减少0.3mol/2L="0.15mol/L," 所以反应开始至2min,用X表示的平均反应速率为0.15mol/L/2min=0.075mol?L-1?min-1
(3)A、该反应是气体的物质的量减小的反应,当达到化学平衡时,混合气体的总物质的量不随时间的变化而变化,正确;B、反应在任何时刻都有单位时间内每消耗3mol X,同时生成2mol Z,不能判定是否达化学平衡状态,错误;C、任何化学反应都遵循质量守恒定律,错误,答案选A。
(4)根据条件对反应速率的影响,①降低温度,反应速率减小;②增大反应物的浓度,反应速率增大;③增大容器的体积相当于减小压强,反应速率减小。
考点:考查化学方程式的推导,反应速率的计算,化学平衡状态的判断,条件对反应速率的影响
本题难度:一般