时间:2025-06-25 23:19:47
1、选择题 将下图中所示实验装置的K闭合,下列判断正确的是 
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生氧化反应
C.甲池与乙池中的溶液互换,闭合K仍有电流产生
D.片刻后可观察到滤纸a点变红色
参考答案:D
本题解析:A、电子沿 Zn→a,b→Cu 路径流动,a与b之间无电子流动,故A错误;B、铜电极上铜离子得电子发生还原反应,故B错误;C、甲池与乙池中的溶液互换,乙池中无法发生得电子反应,闭合K没有电流产生,故C错误;D、锌作负极,铜作正极,湿润的滤纸相当于电解池,滤纸上a作阴极,b作阳极,b上氢氧根离子放电,a上氢离子放电,所以a极附近氢氧根离子浓度增大,滤纸a点变红色,故D正确。
考点:本题考查原电池和电解池原理。
本题难度:一般
2、简答题 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
(1)正极为______(填“a”或“b”)阳极为______.(填“c”或“d”)
(2)阳极电极反应式为______检验该阳极产物的方法是______.
(3)电解一段时间后发现阴极增重6.4g,则外电路中通过的电子的物质的量是______摩尔,若该电解反应所需的电子全部由氢氧燃料电池提供,则至少需要消耗______L氢气(标准状况下)才能满足需要.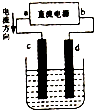
参考答案:(1)由图可知电流从a流向b,则a为电池的正极,b为负极,c与正极相连,所以c为阳极;
故答案为:a;c;
(2)阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=C12↑,氯气具有较强的氧化性能使湿润的淀粉碘化钾试纸变蓝;
故答案为:2Cl--2e-=C12↑;用湿润的淀粉碘化钾试纸检验;
(3)阴极上的电极反应为:Cu2++2e-=Cu,已知阴极增重6.4g,则n(Cu)=6.4g64g/mol=0.1mol,所以转移的电子为0.2mol,氢氧燃料电池中消耗1mol氢气转移2mol电子,所以转移的电子为0.2mol时,消耗的氢气为0.1mol,则V(H2)=nVm=0.1mol×22.4L/mol=2.24L;
故答案为:0.2;2.24L.
本题解析:
本题难度:简单
3、选择题 下列关于铜电极的叙述不正确的是
[? ]
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阳极
C.电解稀硫酸制H2、O2时铜作阳极
D.在镀件上电镀铜时可用金属铜作阳极
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列描述中,不符合生产实际的是? (? )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
参考答案:A
本题解析:A.电解熔融的氧化铝制取金属铝,用石墨作电极。错误。B.电解法精炼粗铜,用纯铜作阴极,用粗铜作阳极。正确。C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极,用石墨作阳极。正确。D.在镀件上电镀锌,用锌作阳极,用镀件作阴极,用含有Zn2+的溶液作电解质溶液。正确。
本题难度:简单
5、填空题 如图为电解装置,X、Y为电极材料,a为电解质溶液。
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是?;
写出Y电极的电极反应式?。
(2)若要实现Cu? +H2SO4=CuSO4+H2↑,
则Y电极材料是?;
写出X电极的电极反应式?。
(3)若要利用该装置在铁制品表面镀上一层银,则a为?,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为?。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH?(填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入?。
参考答案:(1)电极表面产生气体,附近溶液变红? 2分? 2Cl-?-2e-=Cl2↑? 2分
(2)Cu?(1分)? 2H++2e-=H2↑? 2分
(3)AgNO3溶液?(1分)? 0.01NA或6.02×1021? 2分
(4)增大? H2O?各2分
本题解析:根据装置可知,该装置是电解池,Y电极与电源的正极相连,做阳极,X电极与电源的负极相连,做阴极。
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,则阳极Y是溶液中的氯离子放电生成氯气,电极反应式为2Cl-?-2e-=Cl2↑;X电极是溶液中的氢离子放电生成氢气,由于氢离子放电破坏了阴极周围水的电离平衡,所以阴极周围溶液中OH-浓度大于氢离子浓度,溶液显碱性,则X电极附近可观察到的实验现象是电极表面产生气体,附近溶液变红。
(2)根据反应式Cu? +H2SO4=CuSO4+H2↑可知,铜失去电子,溶液中的氢离子得到电子,所以若要实现Cu? +H2SO4=CuSO4+H2↑,则铜做阳极,因此Y电极材料是铜,X电极是阴极,溶液中的氢离子放电,电极反应式为2H++2e-=H2↑。
(3)电镀时待镀金属做阴极,镀层金属做阳极,含有镀层金属离子的溶液做电镀液,所以若要利用该装置在铁制品表面镀上一层银,则a为硝酸银溶液。反应前两电极的质量相等,反应后电极质量相差2.16g,这说明阳极银有1.08g失去电子,而阴极有1.08g银析出,所以该过程理论上通过电流表的电子数为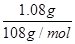 ×6.02×1023/mol=6.02×1021。
×6.02×1023/mol=6.02×1021。
(4)若X、Y均为惰性电极,a为NaOH溶液,则阳极是溶液中的OH-放电,阴极是氢离子放电,这说明相当于是电解水,所以电解一段时间后,氢氧化钠的浓度增大,溶液的pH增大。由于相当于电解水,所以若要使溶液恢复原来的状态,可往溶液中加入水。
本题难度:简单