时间:2025-06-25 23:19:47
1、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是 
[? ]
A.电源B极是正极
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.装置(丁)中X极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
参考答案:D
本题解析:
本题难度:一般
2、填空题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题: 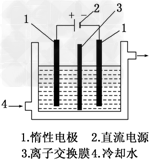
(1)碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为________;阴极上观察到的实验现象是_____________________________.
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表.要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸. 
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________________________________________________________________________.
参考答案:(1)紫黑色;升华
(2)2I--2e-===I2(或I-+6OH--6e-===IO3-+3H2O);有气泡产生
(3)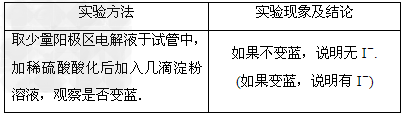 (4)冷却结晶;干燥;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
(4)冷却结晶;干燥;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
本题解析:
本题难度:一般
3、选择题 如图8-4,当阴极增重2.16g时,下列判断正确的是?
A.[AgNO3]=0.08mol/L
B.阳极产生112mL气体(标况)
C.有1.204×1023个电子转移
D.反应中有0.02mol物质被氧化
参考答案:D
本题解析:此装置为电镀池:
阳极:Ag-e=Ag+;阴极(Cu):Ag++e=Ag,所以阴极增重的2.16g为
个,所以C错误。
本题难度:一般
4、填空题 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同) 
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO 和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的____________ 倍。
(3)利用甲醇燃料电池设计如下图所示的装置: ①则该装置中b为________ 极,写出装置中电解池内发生反应的离子方程式____________ , ②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为____________ L。 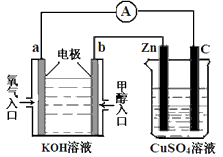
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)== C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)== C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式______________ 。
参考答案:(1)<
(2)0.55
(3)①负; 2Cu2++2H2O 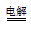 2Cu+O2↑+4H+;②2.24
2Cu+O2↑+4H+;②2.24
(4)C2H4(g)+H2O(l)=== C2H5OH(l) △H=-44.2 kJ/mol
本题解析:
本题难度:一般
5、填空题 已知电极材料:铁、铜、银、石墨、锌、铝;电解 质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因_____________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?____________,若能,请写出电极反应式,负极____________,正极____________ (若不能,后面两空不填)。
(3)若电池反应为:Cu+2H+=Cu2+ +H2↑,该池属于原电池还是电解池?______________,请写出各电极的电极材料和电解质溶液______________。
参考答案:(1)二者连接在一起时,接头处在潮湿的空气中形成原电池而腐蚀
(2)能 ;Cu-2e-==Cu2+? ;2Fe3+ +2e-==2Fe2+
(3)电解池 ;阴极:石墨;阳极:铜;电解液:盐酸或硫酸
本题解析:
本题难度:一般