时间:2019-07-04 02:08:28
1、选择题 下列说法不正确的是
[? ]
A.下列事实不能用勒夏特列原理解释:
①铁在潮湿的空气中生锈
②2HI(g)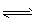 I2(g)+H2(g)达平衡,将体积缩小为原来的1/2,气体颜色加深
I2(g)+H2(g)达平衡,将体积缩小为原来的1/2,气体颜色加深
B.加入浓的NH4Cl溶液,会使Mg(OH)2的溶解沉淀平衡向溶解的方向移动
C.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
D.用氢氧化钠溶液滴定未知浓度的盐酸,碱式滴定管滴定前读数时仰视,结束时读数平视,导致滴定结果偏小
参考答案:C
本题解析:
本题难度:一般
2、选择题 25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
A.原氨水的浓度=10-3mol /L
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中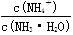 的增大
的增大
D.再加入10mLpH=3的盐酸,混合液pH=7
参考答案:C
本题解析:A、一水合氨是弱电解质,氨水中存在电离平衡NH3·H2O NH4++OH-。所以pH=11的氨水中c(OH-)=10-3mol/L,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于10-3mol/L,故A错误;B、稀释氨水过程中,促进一水合氨电离,氢氧根离子、铵根离子、一水合氨浓度都减小,温度不变,水的离子积常数不变,氢离子浓度增大,故B错误;C、氨水稀释过程中,促进一水合氨电离,铵根离子个数增大,一水合氨分子个数减小,所以溶液中
NH4++OH-。所以pH=11的氨水中c(OH-)=10-3mol/L,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于10-3mol/L,故A错误;B、稀释氨水过程中,促进一水合氨电离,氢氧根离子、铵根离子、一水合氨浓度都减小,温度不变,水的离子积常数不变,氢离子浓度增大,故B错误;C、氨水稀释过程中,促进一水合氨电离,铵根离子个数增大,一水合氨分子个数减小,所以溶液中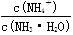 的增大,故C正确;D、常温下,pH=11的氨水和pH=3的盐酸等体积混合,由于盐酸的物质的量浓度小于氨水的,所以等体积混合时氨水的物质的量大于盐酸的物质的量,即氨水是过量的,所以混合溶液呈碱性,故D错误,答案选C。
的增大,故C正确;D、常温下,pH=11的氨水和pH=3的盐酸等体积混合,由于盐酸的物质的量浓度小于氨水的,所以等体积混合时氨水的物质的量大于盐酸的物质的量,即氨水是过量的,所以混合溶液呈碱性,故D错误,答案选C。
本题难度:一般
3、选择题 下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
参考答案:C
本题解析:
本题难度:困难
4、选择题 一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
参考答案:D
本题解析:A、H2S溶液中,存在H2S  ?H+ + HS-、HS-
?H+ + HS-、HS- ?H+ + S2-、H2O
?H+ + S2-、H2O H+ + OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,正确。
H+ + OH-,根据上述反应知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,正确。
本题难度:一般
5、选择题 已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是?
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
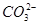
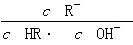 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)参考答案:C
本题解析:根据表中电离常数可知:酸性由强至弱的顺序为CH3COOH>H2CO3>HClO>HCO,结合质子的能力由大到小的顺序为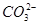 >ClO->
>ClO->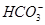 >CH3COO-。A项,ClO-的水解程度大于CH3COO-的水解程度,同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系应是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B项,
>CH3COO-。A项,ClO-的水解程度大于CH3COO-的水解程度,同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系应是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B项,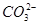 结合质子的能力大于ClO-结合质子的能力,离子方程式应为ClO-+CO2+H2O=HClO+
结合质子的能力大于ClO-结合质子的能力,离子方程式应为ClO-+CO2+H2O=HClO+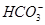 ,错误;C项,
,错误;C项,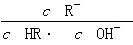 分子、分母同乘以溶液中c(H+),得
分子、分母同乘以溶液中c(H+),得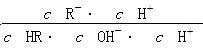 ,该式即为K电离/Kw,温度相同则该式的值相等,正确;D项,CH3COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH3COOH的浓度,错误。
,该式即为K电离/Kw,温度相同则该式的值相等,正确;D项,CH3COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH3COOH的浓度,错误。
本题难度:一般