时间:2019-07-04 02:08:28
1、填空题 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO 、H+、CO
、H+、CO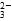 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH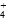 )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。
2、选择题 对室温下体积相同,浓度均为0.1mol?L-1的盐酸和醋酸两种溶液分别采取下列措施.有关叙述中一定正确的是( )
A.加人足量的小苏打固体充分反应后,两溶液中产生的CO2一样多
B.加入NaOH固体恰好中和后,两溶液的pH相同
C.分别加入足量锌粉充分反应,反应开始时两酸产生H2的反应速率相等
D.加水稀释100倍后,两溶液的pH相同
3、计算题 (11分) 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+? ΔH>0。
CH3COO-+H+? ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______?
a.加入少量0.10 mol·L-1的稀盐酸? b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1? d.加入少量冰醋酸
e.加入少量氯化钠固体? f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
4、选择题 下列各组物质中都属于弱电解质的一组物质是(? )?
A. NH3、SO2、H2O、HI B.HF、H2O、NH3?H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S?D.NaHSO3、H2O、CO2、H2CO3
5、填空题 (10分)为了证明醋酸是弱电解质,甲、 乙、丙、丁、戊分别选用下列试剂进行实验: 0.1mol/L醋酸溶液、0.1mol/L盐酸、C(H+)=10-3mol/L的盐酸、C(H+)=10-3mol/L的醋酸、CH3COONa晶体、石蕊试液、pH试纸、锌粒、蒸馏水。已知:pH=-lgc(H+)
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法 (填“正确”或“不正确”)。
(2)乙分别取用10ml 0.1mol/L盐酸和醋酸,然后加入完全一样的等量锌粒(少量),产生氢气用气球收集,通过观察实验现象为 ,则认定醋酸是弱电解质。
(3)丙取出10ml0.10mol/L醋酸溶液,滴入石蕊试液,显红色,再加入醋酸钠晶体,颜色变浅红色,也能证明醋酸是弱电解质,试从电离平衡原理解释 。
(4)丁分别取用10ml C(H+)=10-3mol/L盐酸和醋酸,然后加入完全一样的等量锌粒(足量),产生氢气用气球收集,通过比较产生气球的大小,如果醋酸产生气球 (填“大”或“小”),则认定醋酸是弱电解质。
(5)戊取用C(H+)=10-3mol/L的醋酸稀释到原来的100倍,稀释后醋酸的C(H+) 10-5mol/L
(填“>”、“<”、“=”),则认定醋酸是弱电解质。