时间:2019-07-04 02:08:28
1、选择题 下列说法不正确的是
[? ]
A.下列事实不能用勒夏特列原理解释:
①铁在潮湿的空气中生锈
②2HI(g)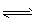 I2(g)+H2(g)达平衡,将体积缩小为原来的1/2,气体颜色加深
I2(g)+H2(g)达平衡,将体积缩小为原来的1/2,气体颜色加深
B.加入浓的NH4Cl溶液,会使Mg(OH)2的溶解沉淀平衡向溶解的方向移动
C.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
D.用氢氧化钠溶液滴定未知浓度的盐酸,碱式滴定管滴定前读数时仰视,结束时读数平视,导致滴定结果偏小
2、选择题 25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
A.原氨水的浓度=10-3mol /L
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中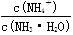 的增大
的增大
D.再加入10mLpH=3的盐酸,混合液pH=7
3、选择题 下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
4、选择题 一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
5、选择题 已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是?
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
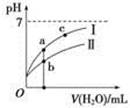
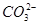
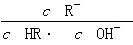 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)