时间:2019-06-25 22:35:07
1、选择题 下列图示与对应的叙述相符的是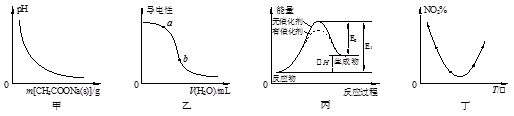
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2 (g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:A、向CH3COOH溶液中逐步加入CH3COONa固体,因为醋酸根离子浓度增大,所以醋酸的电离平衡逆向移动,pH增大,错误;B、醋酸的稀释过程中,氢离子浓度、醋酸根离子浓度均减小,导电性降低,pH增大,所以b>a,错误;C、催化剂只能改变活化能,不能改变反应热,所以丙图表示催化剂改变反应的活化能,错误;D、二氧化氮的含量最低时说明反应达到平衡状态,再升高温度,二氧化氮的含量增大,说明平衡逆向移动,则正反应是放热反应,则△H<0,正确,答案选D。
考点:考查对化学图像的分析,涉及盐的水解、弱电解质的电离、反应活化能、平衡的移动
本题难度:困难
2、选择题 已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF 由此可判断下列叙述不正确的是
[? ]
A.K(HF)=7.2×10-4 mol·L-1
B.K(HNO2)=4.9×10-10 mol·L-1
C.根据两个反应即可得出结论
D.K(HCN)<K(HNO2)<K(HF)
参考答案:B
本题解析:
本题难度:一般
3、选择题 体积相同,pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A.相同
B.HCl多
C.CH3COOH多
D.无法比较
参考答案:C
本题解析:HCl溶液是强电解质溶液,CH3COOH溶液是弱电解质溶液,pH相同时,CH3COOH溶液的浓度更大,故中和是消耗NaOH的物质的量更多。
考点:强弱点接孩子的酸碱中和反应。
本题难度:一般
4、选择题 常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
A.溶液的pH相同
B.分别加入足量锌片,盐酸生成的H2体积大
C.分别稀释100倍后,醋酸浓度与盐酸浓度相等
D.由水电离出的氢离子浓度均为1×10-12 mol·L-1
参考答案:C
本题解析:A、盐酸是强酸,醋酸是弱酸存在电离平衡,因此在物质的量浓度相同的条件下醋酸溶液的pH大,A不正确;B、不能确定酸溶液的体积,因此不能计算产生氢气的体积,B不正确;C、醋酸和盐酸在物质的量浓度相同的条件下稀释相同的倍数后溶液的浓度仍然相等,C正确;D、盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度,所以盐酸溶液中对水的电离抑制程度大,其中盐酸溶液中由水电离出的氢离子浓度为1×10-12 mol·L-1,而醋酸溶液中由水电离出的氢离子浓度大于1×10-12 mol·L-1,D不正确,答案选C。
本题难度:一般
5、选择题
A.2c(Na+)+c(H+)====c(S2-)+c(HS-)+c(OH-)
B.c(Na+)+c(H+)====2c(S2-)+c(HS-)+c(OH-)
C.c(H+)+c(HS-)+2(H2S)====c(OH-)
D.c(Na+)====2c(S2-)+2(HS-)+2c(H2S)
参考答案: A
本题解析:根据电荷守恒,可知A错B对。根据由水电离产生的H+和OH-个数相等,可知C对。根据Na2S中,Na+个数是S2-的两倍,可知D对。
本题难度:一般