时间:2019-06-25 22:35:07
1、选择题 甲酸是一种一元有机酸。下列性质可以证明它是弱电解质的是
[? ]
A.甲酸能与水以任意比互溶
B.1 mol/L甲酸溶液的pH约为2
C.10 mLl mol/L甲酸恰好与10 mL l mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸溶液的弱
2、选择题 可以说明乙酸是弱酸的事实是
A.乙酸不能使酚酞溶液变红色
B.乙酸和Na2CO3反应可放出CO2
C.乙酸能使紫色石蕊试液变红色
D.0.1 mol·L-1的乙酸溶液pH>1
3、推断题 X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下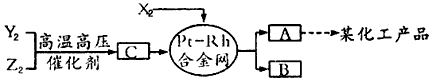
已知:
①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素的周期表中的位置是___________;
(2)X2与Z2可制成新型化学电源(KOH溶液作为电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为__________________;
(3)化合物B吸收C后形成的溶液pH______7(填“大 于”“小于”或“等于”),其原因是(用化学用语表示)_________________
(4)写出由C生成A和B的化学方程式_____________________。
4、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示: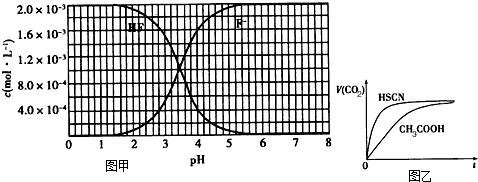
请根据以下信息回答下列问题:
(1)25℃时,将20mL0.10mol/LCH3COOH溶液和20mL0.10mol/LHSCN溶液分别与20mL0.10mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,②反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______.
5、选择题 下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是 (? )
A.将50mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中;
B.将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中
C.在50mL 饱和澄清石灰水中通入CO2直至过量
D.在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的NaOH溶液