时间:2019-06-25 22:35:07
1、选择题 有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
参考答案:C
本题解析:A、溶液①中,CH3COOH电离产生H+,H2O电离也产生H+,所以c(CH3COO-)<c(H+),错误;B、溶液①、②等体积混合,恰好反应生成的CH3COONa浓度为0.05mol?L?1,③中CH3COONa浓度为0.1mol?L?1 CH3COO?浓度不同,错误;C、溶液①、②等体积混合,恰好反应生成CH3COONa,根据物料守恒可知:c(CH3COO-)+c(CH3COOH)=c(Na+),正确D、①、③等体积混合,溶液呈酸性,溶液中c(H+)>c(OH-),根据溶液中电荷守恒知,c(CH3COO-)>c(Na+),错误。
本题难度:一般
2、选择题 草酸是二元中强酸,测得0.01 mol·L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是
A.V(NaOH) = 0时, c(Na+)> c(H+)> c(HC2O4- )> c(C2O42-)> c(OH-)
B.V(NaOH) = 5时, c(Na+)=c(C2O42-)+c(HC2O4- )+c(H2C2O4)
C.V(NaOH) =" 10" mL时, c(Na+) = c(HC2O4- )+2c(C2O42-)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
参考答案:D
本题解析:A选项c(Na+)> c(HC2O4- ) > c(H+) > c(OH-)>c(C2O42-)
B选项物料守恒不正确;C选项电荷守恒不正确
本题难度:一般
3、选择题 将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
[? ]
A.c(H+)
B.Ka(HF)
C.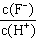
D.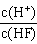
参考答案:D
本题解析:
本题难度:一般
4、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-
H++B2-参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)A、C
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;
(2)根据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10;
(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
本题难度:困难
5、选择题 常温时,将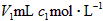 的氨水滴加到
的氨水滴加到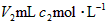 的盐酸中,下列说法正确的是
的盐酸中,下列说法正确的是
[? ]
A.若混合溶液中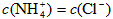 ,则
,则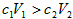
B.若混合液中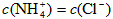 ,则
,则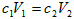
C.若混合液中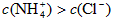 ,则混合液的pH<7
,则混合液的pH<7
D.若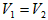 ,且混合液的pH<7,则一定
,且混合液的pH<7,则一定
参考答案:A
本题解析:
本题难度:一般