时间:2019-06-25 22:20:54
1、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHSO3溶液中:c(H+)+c(H2SO3)=c(SO32—)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
参考答案:D
本题解析:0.1 mol·L-1 HCOOH溶液中质子守恒:c(HCOO-)+c(OH-)=c(H+),故A项说法正确;1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中Cu2+、NH4+、SO42—为主体,且Cu2+、NH4+水解溶液呈酸性,故离子浓度大小关系为:c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-),B项说法正确;0.1 mol·L-1 NaHSO3溶液中质子守恒:c(H+)+c(H2SO3)=c(SO32—)+c(OH-),故C项说法正确;等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中存在HX H++X—,与X—+H2O
H++X—,与X—+H2O HX+OH-,但不清楚电离平衡程度大,还是水解程度大,故不能判断c(H+)与c(OH-)的相对大小,D项错误,本题选D。
HX+OH-,但不清楚电离平衡程度大,还是水解程度大,故不能判断c(H+)与c(OH-)的相对大小,D项错误,本题选D。
考点:溶液中离子守恒关系。
本题难度:困难
2、选择题 下列溶液:① CH3COOH ② HCl ③ NaOH ④ CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为
A.③④⑤⑥①②
B.④⑤⑥①③②
C.②①⑥⑤④③
D.②③①⑥⑤④
参考答案:A
本题解析:相同浓度时,酸中氢离子浓度越大其pH越小,①是一元弱酸、②是一元强酸,⑥是强酸弱碱盐,其溶液呈酸性,pH从小到大顺序是:②<①<⑥;③是一元强碱,④是强碱弱酸盐,其溶液呈碱性,,⑤是强酸强碱盐,其溶液呈中性,则pH由大到小排列顺序为③④⑤⑥①②,选A。
考点:考查溶液pH大小的判断。
本题难度:一般
3、选择题 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是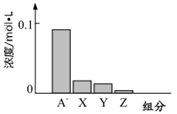
A.将HA加水稀释,溶液中所有粒子的浓度均减小
B.等浓度的HA和NaOH溶液中水的电离程度相同
C.图中X表示HA,Y表示H+,Z表示OH-
D.该混合溶液中: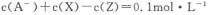
参考答案:D
本题解析:常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液为0.1mol/L NaA溶液,根据题给图像知,A—浓度略小于0.1mol/L,则A—发生水解,HA为弱酸,溶液中微粒浓度大小关系为:c(Na+)>c(A—) >c(OH-) >c(HA) >c(H+)。A、将HA加水稀释,溶液中氢氧根离子的浓度增大,错误;B、HA为弱酸,等浓度的HA和NaOH溶液中水的电离程度前者大于后者,错误;C、图中X表示OH-,Y表示HA,Z表示H+,错误;D、根据电荷守恒知c(Na+)+ c(H+)=c(A—) +c(OH-) ,则该混合溶液中:c(A—) +c(OH-) —c(H+)= c(Na+)=" 0.1mol/L" ,正确。
考点:考查弱电解质的电离和盐类的水解。
本题难度:困难
4、选择题 下列方程式中属于水解反应的是 ?
[? ]
A.HCO3-+H2O H3O++CO32- ?
H3O++CO32- ?
B.HCO3-+H2O OH-+H2CO3 ?
OH-+H2CO3 ?
C.NH3+H2O NH4++OH-? ?
NH4++OH-? ?
D.HCO3-+OH-==?CO32-+H2O
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列物质既能发生消去反应,又能氧化成醛的是( )
A.
B.(CH3)3CCH2CH2OH
C.
D.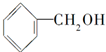
参考答案:B
本题解析:
本题难度:一般