时间:2019-06-25 22:20:54
1、选择题 下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.向煮沸的1mol·L-1NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体
C.等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除
参考答案:D
本题解析:A、氯化铝是强酸弱碱盐,在氯化铝溶液中,氯化铝水解生成氢氧化铝和氯化氢,因为加热会促进水解正向移动,且氯化氢易挥发,所以水解会进行彻底,蒸干、灼烧至恒重,最终生成氧化铝,错误;B、向煮沸的1mol·L-1NaOH溶液中滴加FeCl3饱和溶液,得到氢氧化铁的沉淀,错误;C、一水合氨是弱碱,部分电离,在溶液中存在电离平衡。等体积pH=12的氨水和pH=12的NaOH溶液中,氨水的物质的量浓度大于氢氧化钠,所以氨水中和HCl的物质的量多,错误;D、碳酸钙比硫酸钙更难溶,硫酸钙存在溶解平衡,当加入饱和碳酸钠溶液后,碳酸根离子与钙离子结合为碳酸钙,发生沉淀转化,使硫酸钙的溶解平衡正向移动,则硫酸钙逐渐转化为碳酸钙,碳酸钙再用酸除去,正确,答案选D。
考点:考查盐的水解平衡、沉淀的溶解平衡、强弱电解质的电离及酸碱混合的判断的知识。
本题难度:一般
2、选择题 某有机化合物结构式为:
,它可以发生的反应类型有( )
①取代②加成③消去④水解⑤酯化⑥中和⑦缩聚⑧加聚.
A.①③⑤⑥
B.②④⑥⑧?
C.①②③⑤⑥
D.除④⑧外?
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列离子方程式中,属于水解反应的是
[? ]
A.CH3COOH+H2O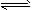 CH3COO- + H3O+
CH3COO- + H3O+
B.CO2+H2O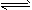 HCO3- + H+
HCO3- + H+
C.SO32- + H2O HSO3- + OH-
HSO3- + OH-
D.HS- + H2O S2- + H3O+
S2- + H3O+
参考答案:C
本题解析:
本题难度:简单
4、选择题 广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。根据上述观点,下列说法不正确的是( )
A.NaClO的水解产物是HClO和NaOH
B.CuCl2的水解产物是Cu(OH)2和HCl
C.PCl3的水解产物是PH3和HClO
D.CaO2的水解产物是Ca(OH)2和H2O2
参考答案:C
本题解析:A、NaClO的水解产物是钠离子和氢氧根离子结合生成的NaOH,次氯酸根离子和氢离子结合生成的HClO,故A正确;B、CuCl2的水解产物是铜离子和氢氧根离子结合生成的Cu(OH)2,氯离子和氢离子结合生成的HCl,故B正确;C、PCl3的水解产物是HCl和P(OH)3,故C错误;D、CaO2的水解产物是钙离子和氢氧根离子结合生成的Ca(OH)2和C22-和氢离子结合生成的C2H2,故D正确.答案选C.
考点:盐类的水解应用
本题难度:一般
5、简答题 (12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
参考答案:(1)-72 kJ·mol-1 (2)CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-
CH3CH(OH)COOH +OH-
(3)① 图1 ②20.00 ③ D ④c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
本题解析:(1)化学反应中化学键断裂吸收能量,形成化学键放出能量,反应热等于反应物的总键能减生成物的总键能。由化学键的键能可知H2(g)+Br2(g)=2HBr(g)△H=(436kJ/mol+200kJ/mol)-2×(369kJ/mol)=-102kJ/mol,因蒸发1mol Br2(l)需要吸收的能量为30kJ,则H2(g)+Br2(l)=2HBr(g)△H为=(-102kJ/mol)+(+30kJ/mol)=-72 kJ/mol。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,由于氢溴酸是强酸,因此有一种酸的pH=4,则该酸一定是氢溴酸,这说明乳酸是弱酸,所以乳酸钠溶液中的水解离子方程式为CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-。
CH3CH(OH)COOH +OH-。
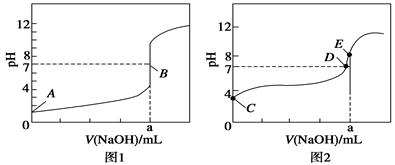
(3)①如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为氢溴酸滴定曲线,。
②滴定20.00mL 0.1000mol/L 氢溴酸溶液,NaOH和HBr恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HBr)=n(NaOH),则a=20.00mL。
③c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,故答案为:D。
④根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
考点:考查反应热计算、水解方程式、酸碱中和反应滴定曲线的有关判断
本题难度:困难