时间:2019-06-25 22:20:54
1、选择题 25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH4+)=c(Cl-),则溶液的pH
A.大于7
B.小于7
C.等于7
D.无法确定
参考答案:C
本题解析:
混合溶液中根据电荷守恒,得c(NH4+)+ c(H+)=c(Cl-)+ c(OH-),已知c(NH4+)=c(Cl-),可得c(H+)=c(OH-),25℃时,混合溶液等于7。
考点:考查电荷守恒
点评:本题考查了盐类水解、电荷守恒,难度不大。解题时注意电荷守恒的应用。
本题难度:一般
2、填空题 工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是 。
A.若反应速率v (SO2)
参考答案:
本题解析:
本题难度:困难
3、填空题 (8分)(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释) 。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为 。
参考答案:(1)酸,< ,Fe 3+ +3 H2O 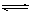 Fe(OH)3+3 H+ ,(2)浓盐酸
Fe(OH)3+3 H+ ,(2)浓盐酸
(3) Fel2O3; (4)Al3++3HCO3-===Al(OH)3↓+3CO2↑.
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
[Na+]>[HCO3-]>[CO32-]>[H+]>[OH-]
本题解析:(1)(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;(2)在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解;(3)氯化铁水解水:Fe3++ 3H2O Fe(OH)3+ 3H+,把FeCl3溶液蒸干,灼烧,Fe(OH)3分解最后得到的主要固体产物是:Fe2O3;(4)Al3+水解溶液呈酸性,而
Fe(OH)3+ 3H+,把FeCl3溶液蒸干,灼烧,Fe(OH)3分解最后得到的主要固体产物是:Fe2O3;(4)Al3+水解溶液呈酸性,而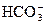 水解溶液呈碱性,相互促进,合并两水解反应方程式即得:Al3++3HCO3-===Al(OH)3↓+3CO2↑;碳酸氢钠在溶液中既存在电离平衡,也存在水解平衡,所以NaHCO3在水溶液中所发生的电离与水解反应的离子方程式有NaHCO3= Na++ HCO3- 、HCO3-
水解溶液呈碱性,相互促进,合并两水解反应方程式即得:Al3++3HCO3-===Al(OH)3↓+3CO2↑;碳酸氢钠在溶液中既存在电离平衡,也存在水解平衡,所以NaHCO3在水溶液中所发生的电离与水解反应的离子方程式有NaHCO3= Na++ HCO3- 、HCO3- H++ CO32-、HCO3-+ H2O
H++ CO32-、HCO3-+ H2O OH-+ H2CO3;其电荷守恒的表达式是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-) ;首先,溶液显碱性,OH->H+,且H+认为是最少的其次,NaHCO3="Na+" + HCO3-,HCO3-
OH-+ H2CO3;其电荷守恒的表达式是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-) ;首先,溶液显碱性,OH->H+,且H+认为是最少的其次,NaHCO3="Na+" + HCO3-,HCO3- H+ + CO32-,即第二步电离,可逆HCO3-+ H2O
H+ + CO32-,即第二步电离,可逆HCO3-+ H2O  H2CO3 + OH-,水解程度略大于电离程度,所以溶液显碱性另外,还存在H2O的电离,H2O
H2CO3 + OH-,水解程度略大于电离程度,所以溶液显碱性另外,还存在H2O的电离,H2O H+ + OH- ,由于HCO3-既有电离的,也有水解的,所以,Na+> HCO3-,由于HCO3-的电离和水解程度都是比较小的,所以,Na+> HCO3->OH->H+ 由于,OH-来自两步反应,HCO3-的水解和H2O的电离,所以比CO32-要多因此,c(Na+)> c(HCO3-) > c(OH-) > c(CO32-)> c(H+)。
H+ + OH- ,由于HCO3-既有电离的,也有水解的,所以,Na+> HCO3-,由于HCO3-的电离和水解程度都是比较小的,所以,Na+> HCO3->OH->H+ 由于,OH-来自两步反应,HCO3-的水解和H2O的电离,所以比CO32-要多因此,c(Na+)> c(HCO3-) > c(OH-) > c(CO32-)> c(H+)。
考点:考查盐类水解的应用,影响盐类水解程度的主要因素。
本题难度:一般
4、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
参考答案:H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒)
CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
本题解析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
考点:考查离子方程式的书写;物质的量浓度的相关计算;弱电解质在水溶液中的电离平衡
本题难度:一般
5、选择题 物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中pH最大的是
A.Na2CO3溶液
B.NH4HCO3溶液
C.NaHCO3溶液
D.NaHSO4溶液
参考答案:C
本题解析:试题分析:既能跟NaOH溶液反应,又能跟盐酸反应的溶液只有NH4HCO3溶液和NaHCO3溶液,NH4+水解呈酸性,所以溶液的pH相对来说比较小,Na+不水解,所以溶液的pH相对来说比较大,因此选C。考点:盐类的水解点评:这类习题是高考重点习题,要掌握盐类水解的规律才能正确的判断溶液的酸碱性强弱。
本题难度:一般