时间:2017-09-24 01:19:07
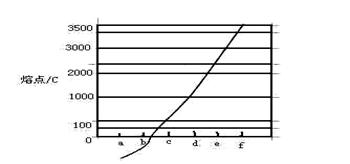
1、填空题 (15分)图1是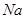 、
、 、
、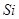 、
、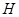 、
、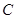 、
、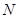 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是?
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是?
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含?个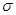 键,?个
键,?个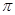 键。
键。
(3)a与b的元素形成的10个电子中性分子X的空间构型为?;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为?,其中X与d 高价离子之间以?键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:?。
(5)图中C单质的晶体堆积方式类型是?,这种堆积方式晶胞中原子的配位数为?。
? ?
?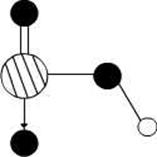
图1?图2
2、选择题 下列说法中,正确的是
[? ]
A.由分子构成的物质中一定含有共价键
B.形成共价键的元素不一定是非金属元素
C.正四面体结构的分子中键角一定是109°28′
D.CO2和SiO2都是直线形分子
3、填空题 试总结第二周期元素Be、B、C、N、O、F生成共价键的规律性,并填入下表中。 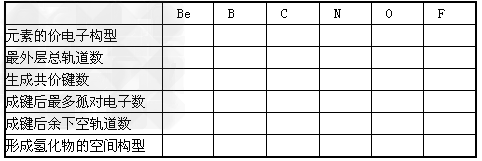
4、填空题 人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将 被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
(1)Ti元素在元素周期表中的位置是第____周期,第____族;其基态原子的价电子层排布为____。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是____;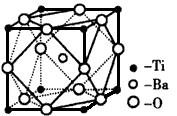
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为 色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液与AgNO3溶液反应得到的沉淀质量的2/3。则绿色晶体配合物的化学式为____,绿色晶体中含有的化学键类型是____。
5、选择题 下列说法正确的是?(?)
A.冰熔化时,分子中H-O键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔点越高
D.分子晶体中,分子间作用力越大,则分子越稳定