时间:2017-09-24 01:19:07
1、选择题 下列电子式中,正确的是( )?
2、选择题 现有四种晶体,其构成粒子(均为单原子核粒子)排列方式如下图所示,其中化学式正确的是
[? ]
A. 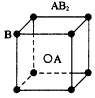
B. 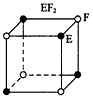
C. 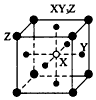
D. 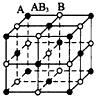
3、选择题 NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞。若再将在成键的C原子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞。则下面说法正确的是(?)(已知C-C键的键长1.54×10-10m)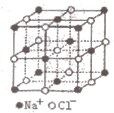
A.一个金刚石的晶胞中有8个C原子
B.金刚石的密度为3.54g·cm-1
C.在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成
D.在该种CO2晶胞中含氧原子8个
4、填空题 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为?。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是?; 1 mol O22+中含有的π键数目为?。氧元素与氮元素能形成多种分子,试写出与N2O分子互为等电子体的一种阴离子?。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为?。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为?。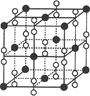
5、填空题 (15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式?。
⑵钾、钙、镓的第一电离能从大到小的顺序是?。
⑶比较氟化钠和溴化钠的熔点:氟化钠?溴化钠(填“<”或“>”),分析其原因是?。
⑷举出两例说明锂与镁具有相似性:①?、②?,这种相似性称为?。
⑸用价层电子对互斥理论推断BF3空间构型为?,NF3分子中N原子的杂化轨道类型为?;在NH3·BF3中接受孤对电子的原子是?。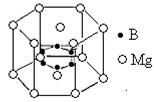
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为?。