时间:2017-08-26 01:46:14
1、填空题 (6分)某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,
(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。
(2)若该溶液呈中性,则溶液中c(NH4+) c(Cl-)(填“>”、“<”或“=”),此时溶液中的溶质有 。
(3)若该溶液由0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合而成,则溶液中四种离子的浓度由大到小的顺序为 。
参考答案:(1)NH4Cl (1分) (2)=(1分) NH4Cl和NH3·H2O(2分)
(3)c(Cl-)>c(H+)>c(NH4+)>c(OH-)(2分)
本题解析:(1)根据离子的种类可知,若该溶液中只有一种溶质,则该溶质只能是NH4Cl 。
(2)根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以如果溶液显中性,则c(H+)=c(OH-),因此c(NH4+)=c(Cl-)。因为如果只有氯化铵,则溶液显酸性,所以要显中性,则一定还含有NH3·H2O。
(3)0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合,生成氯化铵,其中氯化氢是过量的,所以溶液显酸性,因此离子浓度大小顺序是c(Cl-)>c(H+)>c(NH4+)>c(OH-)。
本题难度:困难
2、选择题 下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)="c" (H+)-c (S2-)+c (H2S)
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后,溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-)
C.常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)="c" (CH3COO-)>c (OH-)=" c" (H+)
D.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)="2c" (CO32-)+c (HCO3-)+c (H2CO3)
参考答案:A
本题解析:A.在0.1 mol·L-1的NaHS溶液中存在质子守恒:c (OH-)="c" (H+)-c (S2-)+c (H2S),A正确;B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后,溶液显碱性,溶液中的离子浓度关系:c (NH4+)>c (Cl-)>c (OH-) >c (H+),B错误;C.醋酸钠溶液中滴加少量盐酸使溶液的pH=7,根据电荷守恒,c (Na+)="c" (CH3COO-)+ c (Cl-)>c (OH-)=" c" (H+),C错误;D. 0.1 mol·L-1的Na2CO3溶液中,根据物料守恒,离子浓度关系:c (Na+)="2c" (CO32-)+2c (HCO3-)+2c (H2CO3),D错误;选A。
考点:考查离子浓度的大小比较。
本题难度:困难
3、选择题 为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是
A.NaOH
B.Na2CO3
C.氨水
D.MgO
参考答案:D
本题解析:选项A、B、C中都能引入新的杂质,不正确。氧化镁能消耗溶液中的氢离子,减弱溶液的酸性,所以可以生成氢氧化铁沉淀而除去,且不会引入杂质,答案选D。
考点:考查物质的分离和提纯。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
4、选择题 在55 ℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+) >c(H+)>c(OH-)
参考答案:C
本题解析:A.硫酸氢钠溶液完全电离,电离出的H+抑制水的电离,A项错误;B.Kw=1×10-14mol2/L2是在常温下的数值,而此时温度为55 ℃,无法确定Kw的值,进而无法计算OH-的浓度,B项错误;C.在饱和氯水中存在Cl2+H2O HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42-,所以c(NH4+ )>c(SO42-),D项错误;选C。
HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42-,所以c(NH4+ )>c(SO42-),D项错误;选C。
考点:考查电解质溶液中离子浓度的大小比较。
本题难度:一般
5、选择题 下列有关说法正确的是
A.常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
C.常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-)
参考答案:C
本题解析:A、根据质子守恒,有c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;B、c(OH-)=c(H+),说明溶液呈中性,因为HA的酸性的强弱未知,所以与氢氧化钠恰好完全反应得到的NaA溶液不一定是中性溶液,可能是碱性溶液,错误;C、常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,氢离子浓度缩小为原来的1/10倍,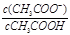 =Ka/ c(H+),醋酸的电离常数不变,氢离子浓度缩小10倍,则比值增大到原来的10倍,正确;D、根据电荷守恒,常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-) >c(CH3COOH) >c(H+)=c(OH-),错误,答案选C。
=Ka/ c(H+),醋酸的电离常数不变,氢离子浓度缩小10倍,则比值增大到原来的10倍,正确;D、根据电荷守恒,常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-) >c(CH3COOH) >c(H+)=c(OH-),错误,答案选C。
考点:考查电解质溶液中离子浓度的比较,守恒规律的应用
本题难度:困难