时间:2017-08-26 01:46:14
1、选择题 下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
2、选择题 下列叙述中正确的是( )
A.所有醇都能发生消去反应
B.苯、乙醇和乙酸都可以发生取代反应
C.乙烯的结构简式可表示为CH2CH2
D.油脂皂化反应基本完成的现象是反应后静置,反应液分为两层
3、选择题 25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
[? ]
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
4、填空题 (18分)(Ⅰ)短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
(1)X在元素周期表中的位置是 ;Y氢化物的电子式 。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈 。(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因是 。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如图所示,该电池的负极反应式 。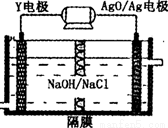
(4)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式 。
(Ⅱ)A、B、C分别是由H、C、O、N、Na、Cu六种元素中的两种或多种元素组成的化合物。现对A、B、C三种化合物分别做以下实验:
A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体,分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性。
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生。将56.8gA隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,生成的Y折合成标准状况下的体积为6.72L,则A的化学式为 。
(2)取B的水溶液2ml与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,则物质B为 。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的溶液显碱性的原因 。(用离子方程式和必要文字解释)
5、选择题 在0.1mol/L的Na2CO3的溶液中,下列关系式正确的是
A.c(Na+)>c(CO32-)> c(OH-)> c(H+)
B.c(OH-)= c(HCO3-)+ c(H2CO3)
C.2c(Na+)=c(CO32-)+ c(HCO3-)> c(H2CO3)
D.c(Na+)+ c(H+)= c(OH-) + c(HCO3-) +2c(CO32-)