时间:2017-08-22 14:34:55
1、选择题 25℃时,pH=5的NH4Cl溶液中,由水电离出的OH-浓度是
A.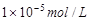
B.1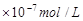
C.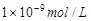
D.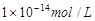
参考答案:A
本题解析:pH=5的NH4Cl是强酸弱碱盐,促进了水的电离,溶液中的H+都是由水电离产生,因为[H+]=1×10-5,由水电离出的OH-浓度是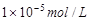 ,选A。
,选A。
考点:考查盐的水解
本题难度:一般
2、填空题 (8分)在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为
(2)若pH=3的强酸HA与pH=11的弱碱MOH混合,则所得溶液显 ,理由是:
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是
参考答案:(1)中性 H++OH-=H2O
(2)碱性 酸HA与碱MOH中和后,碱过量,还会电离出OH-(2分)
(3) 酸性 M++H2O MOH+H+(2分)
MOH+H+(2分)
本题解析:(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH等体积混合,则二者恰好完全反应产生强酸强碱盐,会发生水解反应,因此所得溶液显中性;该反应的离子方程式为H++OH-=H2O;(2)若pH=3的强酸HA与pH=11的弱碱MOH等体积混合,由于弱碱部分电离,碱过量,电离的部分恰好完全中和,未电离的部分会继续电离产生OH-,所以最终使所得溶液显碱性;(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH等体积混合,则二者恰好完全反应产生强酸弱碱盐。由于盐中是弱碱金属阳离子发生水解反应消耗水电离产生的OH-,最终使溶液中的c(H+)> c(OH-),因此所得溶液显酸性。解释这一现象的离子方程式是M++H2O MOH+H+。
MOH+H+。
本题难度:一般
3、选择题 下面提到的问题中,与盐的水解无关的是
①明矾和FeCl3可作净水剂
②实验室保存FeCl3溶液时,要在溶液中加少量盐酸.
③在NH4Cl或AlCl3溶液中加入金属镁会产生氢气.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.
⑥长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用.
⑦比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性.
A.①④⑦
B.②⑤⑥
C.③⑥⑦
D.全有关.
参考答案:D
本题解析:略
本题难度:一般
4、填空题 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 | Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
 ’
’ 参考答案:(1)CuSO4 Ba(OH)2(各1分)
(2)2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl(2分)
(3)溶液由无色变成红色(2分) Al3++3H2O Al(OH)3+3H+(2分)
Al(OH)3+3H+(2分)
(4)500(2分)
(5)c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+)(2分)
(6) (2分)
(2分)
本题解析:由①知,A、C反应产生的沉淀中应是氢氧化铜和硫酸钡沉淀;则A、C是CuSO4、Ba(OH)2中的一种;由②知,B、E只能是盐类,双水解产生气体和沉淀,其中含有Fe3+、CO32-,且其中必有Na2CO3;由③知C为强碱,所以C是Ba(OH)2,A是CuSO4;D为铝盐;由②④知,E为Na2CO3;由⑤知D中有NO3-,所以D为Al(NO3)3,则B只能为FeCl3。
(1)A、C的化学式为:CuSO4、Ba(OH)2
(2)步骤②是Fe3+、CO32-的双水解反应,化学方程式为2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl;
(3)Al(NO3)3溶液由于Al3+水解而是溶液显酸性,所以加入石蕊试液,溶液变红色,离子方程式为Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)根据Cu与稀硝酸反应的离子方程式3Cu+8H++2N3-=3Cu2++2NO↑+4H2O,得3Cu~8H+,38.4 g Cu的物质的量为0.6mol,所以需要硫酸的物质的量是0.8,其体积为500mL;
(5)由题意知n(CO2)=0.5mol,n(Na2CO3)=1.5mol,所以二者反应后溶液中有1mol的NaHO3,1mol的Na2CO3,
Na2CO3水解程度大于NaHO3水解程度,所以溶液中离子浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+)(2分)
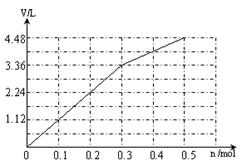
(6)阳极先是Cl-放电,溶液中共有0.3mol Cl-,根据2 Cl- +2 e-= Cl2↑,得转移电子0.3mol时产生气体标准状况下的体积是3.36L;然后是氢氧根离子放电,4OH--4 e-=O2↑+2H+,每转移0.1mol电子就生成0.56L的气体,所以图像如下: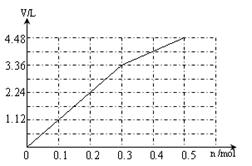
考点:考查化合物的判断,离子反应,盐的水解,氧化还原反应的计算,离子浓度的比较,电解原理的应
用
本题难度:困难
5、简答题 现有下列5种有机物:①甲苯、②乙醛、③乙酸乙酯、④苯酚、⑤乙烯.
(1)上述物质中能发生水解反应的是(填序号,下同)______;能发生银镜反应的是______;属于聚合物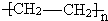 的单体是______.
的单体是______.
(2)上述物质有1种能与浓溴水反应产生白色沉淀,写出反应的化学方程式______.
参考答案:(1)③乙酸乙酯含有酯基,能发生水解反应;②乙醛含有醛基,能发生银镜反应;聚合物 的单体即为将两个半键闭合即可,即CH2═CH2;
的单体即为将两个半键闭合即可,即CH2═CH2;
故答案为:③;②;⑤;
(2)苯酚能与浓溴水反应产生三溴苯酚白色沉淀,方程式为: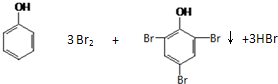 ,故答案为:
,故答案为: ;
;
本题解析:
本题难度:简单