时间:2017-08-22 14:34:55
1、选择题 下列溶液,阴离子总浓度最大的是( )
A.0.2 mol / L NaCl
B.0.1 mol / L Ba(OH)2
C.0.2 mol / L K2S
D.0.2 mol / L (NH4)2SO4
参考答案:C
本题解析:本题主要考查电离和水解情况;电离出来的阴离子浓度A、B、C、D分别为0.2、0.2、0.2、0.2;由于S2-水解S2-+H2O HS-+OH-;故离子数目增多,答案选C。
HS-+OH-;故离子数目增多,答案选C。
本题难度:一般
2、简答题 某二元酸H2A的电离情况为:H2A=H++HA-;HA-?H++A2-.请据此回答下列有关问题:
(1)Na2A溶液呈______(填“弱酸性”、“中性”或“弱碱性”),其理由是______(用离子方程式表示).
(2)写出NaHA溶液中溶质电离常数(Ka)的表达式______.
(3)如果25℃时,0.10mol?L-1?H2A溶液的pH=-lg0.11,则0.10mol?L-1的H2A溶液中c(A2-)=______mol?L-1.
参考答案:(1)H2A的第一步电离是完全电离,第二步电离是不完全电离,所以A2-能水解导致溶液中氢氧根离子浓度大于氢离子浓度,而使溶液呈溶解性,水解离子方程式为:A2-+H2O?OH-+HA-;
故答案为:弱碱性,A2-+H2O?OH-+HA-;
(2)HA-离子存在电离平衡,电离平衡常数Ka=C(H+).C(A2-)C(HA-);
故答案为:Ka=C(H+).C(A2-)C(HA-);
(3)H2A的第一步电离是完全电离,第二步电离是不完全电离,第二步电离的氢离子浓度等于c(A2-),0.10mol?L-1?H2A溶液中第一步电离得到的氢离子浓度为0.1mol/L,因为溶液的pH=-lg0.11,所以第二步电离的氢离子浓度为0.01mol/L,溶液中c(A2-)等于第二步电离的氢离子浓度,则0.10mol?L-1的H2A溶液中c(A2-)=0.01mol/L;
故答案为:0.01.
本题解析:
本题难度:一般
3、选择题 部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
参考答案:D
本题解析:根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO3-,A错误,B正确;等体积、等pH的HCOOH和HCN溶液所含溶质HCN溶液更多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
本题难度:一般
4、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH )=c(Cl-)
)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c (HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
参考答案:C
本题解析:A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液,根据电荷守恒可得:c(H+)+ c(NH )= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
)= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
考点:考查微粒的物质的量浓度关系正误判断的知识。
本题难度:困难
5、选择题 由下列物质所配成的0.l mol  的溶液中,离子浓度由大到小的顺序正确的是
的溶液中,离子浓度由大到小的顺序正确的是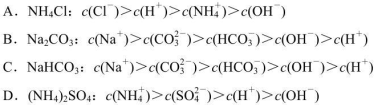
参考答案:D
本题解析:A.氯化铵属于强酸弱碱盐,水解显酸性,但水解程度非常小,所以NH4Cl溶液中离子浓度大小顺序为C(Cl-)>C(NH4+)>C(H+)>C(OH-),错误;B.碳酸钠溶液属于多元弱酸盐,分步水解,溶液显碱性,离子浓度大小顺序为C(Na+)>C(CO32-)>C(0H-)>C(HCO3-)>C(H+),错误;C.碳酸氢钠溶液显碱性,HCO3-的水解程度大于其电离程度,离子浓度大小顺序为C(Na+)>C(HCO3-)>C(0H-)>C(CO32-)>C(H+),错误;D.硫酸铵属于强酸弱碱盐,水解显酸性,离子浓度大小顺序为C(NH4+)>C(SO42-)>C(H+)>C(OH-),正确;选D。
考点:考查盐溶液中离子浓度的大小比较。
本题难度:一般