时间:2017-08-10 00:50:37
1、选择题 对于常温下pH为2的盐酸,叙述正确的是
A.溶液中c(H+)=c(Cl—)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍
D.与等体积0.01 moI·L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
参考答案:C
本题解析:A、根据电荷守恒可知c(H+)=c(Cl—)+c(OH—),A不正确;B、一水合氨是弱碱,存在电离平衡,则pH=12的氨水溶液的浓度大于0.01mol/L,所以与pH=2的盐酸等体积混合后,氨水过量,溶液显碱性,B不正确;C、盐酸是强酸,抑制水的电离平衡。溶液中c(H+)=0.01mol/L,则根据水的离子积常数可知,溶液中c(OH—)= =1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。
=1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。
本题难度:一般
2、选择题 室温下,0.1mol·L-1某一元弱碱(AOH)溶液中c(OH-)/c(H+)=1.0×108,下列叙述不正确的是
A.该一元碱溶液的pH=11
B.该溶液中由水电离出的c(OH-)=1.0×10-11mol·L-1
C.该溶液中水的离子积常数KW为1.0×10-14mol·L-2
D.用pH=1的盐酸溶液V1L与V2L0.1mol·L-1的AOH溶液混合,若混合溶液pH=7,则V1=V2
参考答案:D
本题解析:常温下,水的离子积常数KW为1.0×10-14mol·L-2,又由于该碱溶液中c(OH-)/c(H+)=1.0×108,可得c(OH-)=1.0×10-3mol·L-1,c(H+)=1.0×10-11mol·L-1
A:c(H+)=1.0×10-11mol·L-1,pH=11,正确
B:碱溶液中H+全部来自于水的电离,故由水电离出的c(OH-)=1.0×10-11mol·L-1,正确
C:KW只与温度有关,正确
D:由题意知,酸碱两溶液的浓度相同,若体积也相同,则恰好中和生成强酸弱碱盐,溶液将呈酸性,不正确
答案为D
本题难度:一般
3、选择题 燃烧热与反应热的关系是
A.当一个反应是燃烧反应时,该燃烧反应的反应热就是燃烧热
B.燃烧热是反应热的一种类型
C.燃烧热不属于反应热,反应热是在25 ℃、101 kPa下测定的,而燃烧反应的温度要高
D.反应热有正负之分,燃烧热全部是正值
参考答案:B
本题解析:
试题解析:燃烧热必须生成稳定的氧化物时放出的热量,而燃烧反应不一定生成稳定的氧化物,反应热不一定是燃烧热,A错误;燃烧热是一定条件下的反应热属于化学反应的反应热,故B正确;燃烧热是反应热的一种类型,两者反应条件是相同的,C错误;燃烧热全部是放热反应,全部为负值,D错误。
考点:反应热;燃烧热
本题难度:一般
4、选择题 随着能源危机影响的加剧,全球寻找新能源的步伐加快,下列几种能源中不属于新能源的是
A.石油
B.风能
C.太阳能
D.潮汐能
参考答案:A
本题解析:新能源指太阳能、地热能、风能、海洋能、生物质能、核聚变能等,B、C、D属于新能源;石油属于化石能源,符合题意。
考点:考查新能源。
本题难度:一般
5、选择题 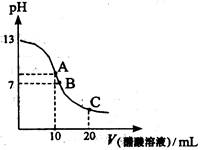
A.在A点:c(Na+)> c(OH—)> c(CH3COO—)> c(H+)
B.在A点:c(Na+)+ c(H+)==c(OH—)+c(CH3COO—)
C.在B点:c(CH3COO—)> c(Na+)> c(H+)= c(OH—)
D.在C点:c(CH3COO—)> c(Na+)> c(H+)> c(OH—)
参考答案:BD
本题解析:在A点氢氧化钠与醋酸恰好完全反应生成醋酸钠溶液,醋酸钠溶液中醋酸根离子会部分水解使溶液呈碱性,所以在A点:离子浓度大小顺序为:c(Na+)>c(CH3COO—)> c(OH—)> ?c(H+),且据电荷守恒知B对;在B点溶液恰好呈中性,故有c(H+)= c(OH—),据电荷守恒可知c(Na+)=c(CH3COO—),故C不对;在C点醋酸刚好有一半过量,即反应后溶液为等浓度的醋酸钠和醋酸的混合溶液,此时应以醋酸的电离为主,即醋酸的电离大于醋酸根离子的水解,故D也对。
本题难度:一般