时间:2017-08-10 00:50:37
1、选择题 pH相同的醋酸和盐酸,分别用蒸馏水稀释至原来体积的m倍和n倍。稀释后的溶液的pH仍相等,则m和n的关系是
A.m>n
B.m=n
C.m<n
D.不能确定
参考答案:A
本题解析:醋酸是弱酸,存在电离平衡。而稀释有利于电离,所以pH相同的醋酸和盐酸如果稀释相同的倍数,则醋酸的酸性强于盐酸的,所以要使pH相等,则醋酸还要继续加水,因此答案选A。
本题难度:一般
2、选择题 下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
①C4H10(g)+
| 13 2 |
| 13 2 |
| 9 2 |
| 9 2 |
参考答案:正丁烷的燃烧热是指1mol正丁烷完全燃烧生成气态CO2,液态H2O放出的热量,所以表示燃烧热的热化学方程式为:C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-2878kJ/mol,正丁烷的燃烧热为-2878kJ/mol.故选:A.
本题解析:
本题难度:简单
3、实验题 (14分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g。
步骤Ⅱ 将样品溶解在250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)上述操作步骤Ⅱ是否正确________(填“是”或“否”);若不正确,请改正_______________________________________________。(若正确,此空不填)
(2)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,溶液最终变成____________色。
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
参考答案:⑴否;将样品溶解在小烧杯中,冷却后转移至容量瓶中。
⑵①偏高 ②无影响 ③B ④红色 ⒀18.85﹪
本题解析:(1)容量瓶不能直接溶解物质配制溶液,所以操作错误。应该将样品溶解在小烧杯中,冷却后转移至容量瓶中。
(2)①碱式滴定管用蒸馏水洗涤后需要再用NaOH溶液润洗,否则相当于NaOH溶液被稀释,滴定消耗的体积会偏高,测得样品中氮的质量分数也将偏高。?②锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+?的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,也就是无影响。③注意观察颜色变化,确定滴定终点。?④待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红)。
(3)标准溶液的体积应取三次实验的平均值,
首先确定滴定时所用的NaOH标准溶液为(20.01+19.99+20.00)/3=20.00mL
根据题意中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,滴定结果,溶液中含有H+(含(CH2)6N4H+)共0.02?0.1010=0.00202mol
根据反应式,每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol
所以共消耗NH4+0.00202mol
其中含氮元素0.00202?14=0.02828g
所以氮的质量分数为0.02828/0.15?100%=18.85%
点评:本题考查了中和滴定实验的原理以及操作步骤(①准备:洗涤→检漏→润洗→注液→调液→读数。?②滴定:移液(放液)→滴加指示剂→滴定终点→读数→重复2~3次→计算(取平均值)。
本题难度:一般
4、选择题 常温下,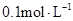 某一元酸
某一元酸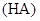 溶液中
溶液中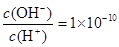 ,下列说法正确的是( )
,下列说法正确的是( )
A.溶液中由水电离出的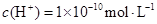
B.溶液中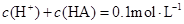
C.与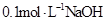 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中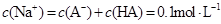
D.原溶液中加入一定量NaA晶体或加水稀释,溶液中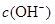 均增大
均增大
参考答案:D
本题解析:结合常温下水的离子积可计算出溶液中c(H+)=1×10—2mol/L,c(OH—)=1×10—12mol/L,可见酸HA为部分电离,属于弱酸
A:酸溶液中OH—全部由水电离产生,故水电离出c(H+)=1×10—12mol/L
B:由物料守恒可知c(HA)+c(A—)=0.1mol/L
C:两溶液混合后,体积增大一倍,故c(Na+)=c(HA)+c(A—)=0.05mol/L
D:电离平衡HA H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
H++A—可知,加入NaA晶体时,A—浓度增大,平衡左移,c(H+)减小,c(OH—)增大;加水稀释,溶液酸性减弱,c(H+)减小,c(OH—)增大,故正确
答案为D
本题难度:简单
5、选择题 有200 mL MgCl2和 AlCl3的混合溶液,其中c(Mg2+)=0.2 mol/L,c(Cl-)=1.3 mol/L,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol/L NaOH 溶液的体积是:
A.40 mL
B.72 mL
C.80 mL
D.128 mL
参考答案:C
本题解析:溶液中Mg2+和Cl-的物质的量分别为0.04mol和0.26mol,根据溶液的电中性可知,溶液中Al3+的物质的量为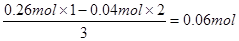 。当Mg2+全部转化为沉淀分离出来后,溶液中只有NaAlO2和NaCl,根据原子守恒可知,它们的物质的量分别为0.06mol和0.26mol。根据钠原子守恒可知氢氧化钠的物质的量为0.06mol+0.26mol=0.32mol,所以需要4 mol/L NaOH 溶液的体积是
。当Mg2+全部转化为沉淀分离出来后,溶液中只有NaAlO2和NaCl,根据原子守恒可知,它们的物质的量分别为0.06mol和0.26mol。根据钠原子守恒可知氢氧化钠的物质的量为0.06mol+0.26mol=0.32mol,所以需要4 mol/L NaOH 溶液的体积是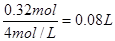 。所以答案是C。
。所以答案是C。
本题难度:一般