时间:2017-08-06 11:02:45
1、简答题 现有A、B、C、D、E五种短周期主族元素,且从A到E原子序数依次增大,已知A和C元素的原子最外层电子数相同,C、D、E元素的原子电子层数相同,A元素的原子核中只有质子、无中子,B元素的原子核外最外层电子数是电子层数的3倍,D元素的原子核外电子数比C元素的原子核外电子数多2个,E元素的原子半径在同周期中是最小的(稀有气体元素除外).请回答下列问题:
(1)D元素的名称是______,E离子的原子结构示意图为______;
(2)用电子式表示化合物CE的形成过程______;
(3)A、B两元素形成的化合物A2B2的结构式是______;
(4)将D元素所形成的单质与Mg用导线连接插入有A、B、C三种元素所形成的化合物的水溶液中构成原电池,则该原电池的正极为______(填元素符号),该原电池总反应的离子方程式为:______.
2、选择题 下列说法正确的是
[? ]
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
3、选择题 X,Y,Z,M,N五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;?Y,M同主族,可形成MY2,MY3两种分子.一下列说法正确的是( )
A.原子半径:N>Z
B.单质的氧化性:Y>M
C.X、Z,M的氧化物均为共价化合物
D.M,N的最高价氧化物对应的水化物均属于强酸
4、填空题 卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl? B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是?,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子?。
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的?两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。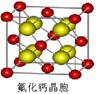
5、选择题 下列物质所对应的化学式正确的是( )
A.烧碱--Ca(OH)2
B.胆矾--CuSO4
C.过氧化钠--Na2O
D.石膏--CaSO4?2H2O