时间:2017-08-06 11:02:45
1、选择题 在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是(?)。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列叙述正确的是?
[? ]
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
参考答案:D
本题解析:
本题难度:简单
3、选择题 有关化学键的下列叙述中正确的是( )
A.由两种元素组成的共价化合物分子,只存在极性键
B.不同种非金属元素原子之间形成的化学键都是极性键
C.离子化合物一定不含共价键
D.共价化合物可能不含离子键
参考答案:B
本题解析:
本题难度:简单
4、选择题 以下说法正确的是
[? ]
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
参考答案:A
本题解析:
本题难度:简单
5、简答题 有四种元素xA、yB、zC、mD,x、y、z、m为质子数.己知:
①C、D、B在同一周期,其中B原子的L层电子数比K层和M层电子数之和少一个;
②D的+1价阳离子的电子层结构与Ne原子相同;
③A原子的质子数与中子数相等,且A的原子质量数与D的中子数相等,而C的质子数比中子数少一个;x+y+z+m=48.试回答:
(1)A为______.在周期表中位置______;D的离子结构示意图______.
(2)写出A、B、C、D的最高价氧化物的分子式:______.
(3)写出C、D最高价氧化物水化物反应的化学方程式______,A的最高价氧化物与D的最高价氧化物的水化物反应的化学方程式______.
(4)写出A的氧化物的结构式______,分子空间构型为______.
参考答案:有四种元素xA、yB、zC、mD,x、y、z、m为质子数.D的+1价阳离子的电子层结构与Ne原子相同,则D为Na元素;C、D、B在同一周期,处于第二周期,B原子的L层电子数比K层和M层电子数之和少一个,则其M层电子数为8+1-2=7,则B为Cl元素;A原子的质子数与中子数相等,且A的原子质量数与D的中子数相等,则A原子质子数为122=6,故A为碳元素;x+y+z+m=48,则z=48-6-11-17=14,故C为Si元素,
(1)A为碳元素,在周期表中位置为:第二周期ⅣA族;D为Na元素,其离子结构示意图为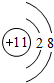 ,故答案为:碳;第二周期ⅣA族;
,故答案为:碳;第二周期ⅣA族;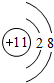 ;
;
(2)C、Cl、Si、Na的最高价氧化物的分子式分别为:CO2,Cl2O7,SiO2,Na2O,故答案为:CO2,Cl2O7,SiO2,Na2O;
(3)Si、Na最高价氧化物水化物为H2SiO3、NaOH,反应的化学方程式为H2SiO3+2NaOH△.Na2SiO3+2H2O,A的最高价氧化物CO2,与NaOH反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,
故答案为:H2SiO3+2NaOH=Na2SiO3+2H2O;CO2+2NaOH=Na2CO3+H2O;
(4)A的氧化物为CO2,结构式为O=C=O,分子空间构型为直线型,故答案为:O=C=O;直线型.
本题解析:
本题难度:一般