时间:2017-08-06 11:02:45
1、简答题 现有A、B、C、D、E五种短周期主族元素,且从A到E原子序数依次增大,已知A和C元素的原子最外层电子数相同,C、D、E元素的原子电子层数相同,A元素的原子核中只有质子、无中子,B元素的原子核外最外层电子数是电子层数的3倍,D元素的原子核外电子数比C元素的原子核外电子数多2个,E元素的原子半径在同周期中是最小的(稀有气体元素除外).请回答下列问题:
(1)D元素的名称是______,E离子的原子结构示意图为______;
(2)用电子式表示化合物CE的形成过程______;
(3)A、B两元素形成的化合物A2B2的结构式是______;
(4)将D元素所形成的单质与Mg用导线连接插入有A、B、C三种元素所形成的化合物的水溶液中构成原电池,则该原电池的正极为______(填元素符号),该原电池总反应的离子方程式为:______.
参考答案:A、B、C、D、E五种短周期主族元素,且从A到E原子序数依次增大,A元素的原子核中只有质子、无中子,则A为H元素;B元素的原子核外最外层电子数是电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C、D、E元素的原子电子层数相同,原子序数大于O,故应处于第三周期,A和C元素的原子最外层电子数相同,可推知C为Na,D元素的原子核外电子数比C元素的原子核外电子数多2个,故D为Al,E元素的原子半径在同周期中最小,则E为Cl,
(1)由上述分析可知,D为铝元素,Cl-离子原子结构示意图为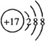 ,故答案为:铝;
,故答案为:铝; ;
;
(2)NaCl属于离子化合物,用电子式表示化合物NaCl的形成过程为 ,
,
故答案为: ;
;
(3)H、O两元素形成的化合物H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其结构式是H-O-O-H,
故答案为:H-O-O-H;
(4)将Al元素所形成的单质与Mg用导线连接插入有NaOH的水溶液中构成原电池,Al与NaOH溶液反应生成偏铝酸钠与氢气,Al发生氧化反应,为负极,Mg电极上发生还原反应,为正极,该原电池总反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Mg;2Al+2OH-+2H2O=2AlO2-+3H2↑.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
参考答案:B
本题解析:
本题难度:简单
3、选择题 X,Y,Z,M,N五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;?Y,M同主族,可形成MY2,MY3两种分子.一下列说法正确的是( )
A.原子半径:N>Z
B.单质的氧化性:Y>M
C.X、Z,M的氧化物均为共价化合物
D.M,N的最高价氧化物对应的水化物均属于强酸
参考答案:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体).
A.同一周期元素,原子半径随着原子序数的增大而减小,所以原子半径N<Z,故A错误;
B.同一主族,单质的氧化性随着原子序数的增大而减小,所以单质的氧化性:Y>M,故B正确;
C.Z是活泼金属元素,其氧化物是离子化合物,故C错误;
D.M、N分别是S、Cl元素,都是非金属性较强的元素,所以其最高价氧化物对应的水化物分别是硫酸和高氯酸,均属于强酸,故D正确;
故选BD.
本题解析:
本题难度:简单
4、填空题 卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl? B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是?,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子?。
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的?两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。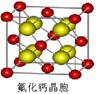
参考答案:(1)H-F(1分) MgF2﹥NaF﹥SiF4 (2分)
(2)A?(2分)
(3)CH3Cl、SCl2(2分)? sp3杂化(2分)? PCl3(或NCl3等)(2分)
(4)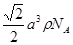 ?(2分)
?(2分)
本题解析:(1)由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;卤素原子与氢原子形成的共价键中,都含有氢原子,其它元素的非金属性大小关系为:F>Cl>Br>I,所以极性键的极性大小关系为:H-F>H-Cl>H-Br>H-I;NaF MgF2为离子晶体所以熔点高于分子晶体SiF4,在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,所以NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是MgF2﹥NaF﹥SiF4。
(2)加热多卤化物则离解为简单的卤化物和卤素单质。CsBr3=CsBr+Br2,若为多种卤素的多卤化物,则离解生成具有最高晶格能的一种卤化物,如:CsICl2=CsCl+ICl,而不是CsI+Cl2,所以选A。
(3)组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,所以BF3属于非极性分子,SCl2属于极性分子,CH3Cl空间结构为四面体形,不是正四面体,正负电荷的中心不重合,属于极性分子。ClO2-中价层电子对个数=2+1/2(7+1-2×2)=2,且含有2个孤电子对,所以空间构型是V型,sp3杂化;等电子体是指具有相同电子数目和原子数目的分子或离子,SO32-中有4个原子,6+6×3+2=26个价电子。
(4)该晶胞中含有钙离子个数=1/8×8+6×1/3 =4,氟离子个数=8,,相邻最近的两个Ca2+的核间距是正方体对角线的一半,所以正方体的边长为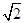 a cm,ρ=
a cm,ρ= 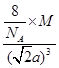 ?,所以CaF2的相对分子质量可以表示为
?,所以CaF2的相对分子质量可以表示为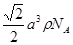 。
。
本题难度:一般
5、选择题 下列物质所对应的化学式正确的是( )
A.烧碱--Ca(OH)2
B.胆矾--CuSO4
C.过氧化钠--Na2O
D.石膏--CaSO4?2H2O
参考答案:A、烧碱是氢氧化钠,化学式为NaOH,故A错误;
B、胆矾是硫酸铜晶体,化学式为CuSO4?5H2O,故B错误;
C、过氧化钠是钠离子与过氧根离子形成的离子化合物,化学式为Na2O2,故C错误;
D、石膏的化学式为CaSO4?2H2O,故D正确.
故选D.
本题解析:
本题难度:一般