时间:2017-08-06 10:44:46
1、填空题 实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:
⑴写出H2CO3的电离方程式为 ;
⑵Na2CO3溶液显碱性,原因是(用离子方程式表示)
;(2分)
⑶在该溶液中,c(Na+)、c(CO32-) 、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;(2分)
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;(2分)
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。(2分)
2、实验题 (12分)硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:
已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
3、填空题 (9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;4、选择题 常温下,下列有关0.1mol·L-1 Na2CO3溶液的说法正确的是
A.升高温度,促进CO32-水解,pH增大
B.离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
B.离子浓度:c(Na+)+c(H+) =c(HCO3-)+c(CO32-) +c(OH-)
D.离子浓度:c(Na+)> c(CO32-)>c(H+)>c(OH-)> c(HCO3-)
5、填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。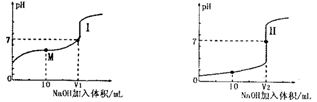
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。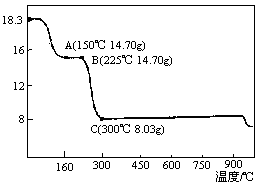
(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。