时间:2017-08-06 10:44:46
1、选择题 25℃时,pH=5的NH4Cl溶液中,由水电离出的OH-浓度是
A.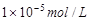
B.1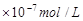
C.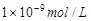
D.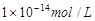
参考答案:A
本题解析:pH=5的NH4Cl是强酸弱碱盐,促进了水的电离,溶液中的H+都是由水电离产生,因为[H+]=1×10-5,由水电离出的OH-浓度是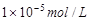 ,选A。
,选A。
考点:考查盐的水解
本题难度:一般
2、简答题 (12分)研究表面,可用NaBH4与水反应制氢氧燃料电池的氢气:BH4-+2H2O=BO2-+4H2↑(实质为水电离产生的H+被还原)。下表为pH和温度对本反应中NaBH4半衰期的影响(半衰期是指反应过程中,NaBH4的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH | 不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4. 32 ×100 | 6. 19 ×10-1 | 8. 64 ×10-2 | 1.22 ×10-2 |
| 10 | 4. 32 ×102 | 6. 19 ×101 | 8. 64 ×100 | 1.22 ×100 |
| 12 | 4. 32 ×104 | 6. 19 ×103 | 8. 64 ×102 | 1.22 ×102 |
| 14 | 4. 32 ×106 | 6. 19 ×105 | 8. 64 ×104 | 1.22 ×104 |
参考答案:(1)c(Na
本题解析:
本题难度:一般
3、选择题 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA
和NaB混合溶液中,下列排序正确的是( )
A.c( )>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
C.c( )>c(B-)>c(A-)>c(H+) D. c(
)>c(B-)>c(A-)>c(H+) D. c( )>c(HB)>c(HA)>c(H+)
)>c(HB)>c(HA)>c(H+)
参考答案:B
本题解析:由于HA的酸性比HB的酸性弱,则NaA的水解程度大于NaB的水解程度,且强碱弱酸盐水解呈碱性,存在A-+H2O=HA+OH-,B-+H2O=HB+OH-,所以c(OH—)>c(HA)>c(HB)>c(H+)
故选B
考点:盐类水解的原理
点评:本题考查离子浓度大小的比较,明确酸性越弱,盐的水解程度越大是解本题的关键。
本题难度:简单
4、选择题 常温下,pH=3的二元弱酸H2R溶液与a LpH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A.c(R2-)>c(Na+)>c(H+)=c(OH-)
B.2c(R2-)+c(HR-)=c(Na+)
C.c(R2-)+c(OH-)=c(Na+)+c(H+)
D.混合液的体积为2a L
参考答案:B
本题解析:电荷守恒.2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),c(H+)=c(OH-)(中性),即此答案.
本题难度:困难
5、选择题 在0.1mol·L-1 的Na2CO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO32-)
B.c(HCO3-)>c(H2CO3)
C.c(Na+)<[c(CO32-)+c(HCO3-)]
D.c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
参考答案:B
本题解析:碳酸钠是强碱弱酸盐,CO32-水解显碱性,因此c(Na+)>2c(CO32-) ,A不正确。由于CO32-的第一步水解大于第二步水解,所以选项B正确。C不正确,不符合物料守恒,应该是c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]。D不正确,不符合质子守恒,应该是c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),答案选B。
本题难度:困难