时间:2017-08-06 10:26:14
1、选择题 常见的晶体有如下类型:①分子晶体;②离子晶体;③原子晶体;④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是
A.①②③④
B.只有①③④
C.只有①②③
D.只有①③
参考答案:C
本题解析:略
本题难度:简单
2、选择题 上个世纪80年代,科学家通过研制发现了一种新分子,这种新分子具有空心的类似足球状的结构,其化学式是C60。有关C60的下列说法中正确的?
A.C60中可能含有离子键
B.C60中的化学键只有共价键
C.C60是一种新型的化合物
D.C60是一种混合物
参考答案:B
本题解析:略
本题难度:一般
3、选择题 已知X、Y、Z二种元素组成的化合物是离子晶体,其晶胞如图l所示,则下列表示该化合物的化学式正确的是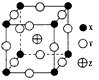
[? ]
A.ZXY3
B.ZX2Y6
C.ZX4Y8
D.ZX8Y12
参考答案:A
本题解析:
本题难度:简单
4、选择题 PCl3的分子结构是( ? )
A.平面三角形,键角小于120°
B.平面三角形,键角是120°
C.三角锥形,键角小于109°28′
D.三角锥形,键角是109°28′
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列分子中,各原子未处于同一平面上的是
[? ]
A、NH3
B、C2H4
C、H2O
D、CH2O
参考答案:A
本题解析:
本题难度:简单