时间:2017-08-06 10:26:14
1、填空题 (1)利用VSFPR模型推断下列分子或离子的空间构型。
PO43-____; CS2____; AlBr3(共价分子)____。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的两种粒子的球棍模型,写出相应的化学式 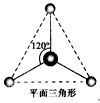 ___________;
___________;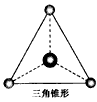 ___________
___________
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
参考答案:(1)四面体形;直线形;平面三角形
(2)CH3+;CH3-
(3)BF3;NF3;CF4
本题解析:
本题难度:一般
2、选择题 高温下,超氧化钾晶体呈立方体结构。 晶体中氧的化合价部分为O,部分为-2 价。下图为超氧化钾晶体的一个晶胞。则下列说法正确的是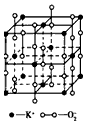
[? ]
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为1:1
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知氯化钠的摩尔质量是58.5g/mol,密度是2.2g/ cm 3,则氯化钠晶体中相邻的钠离子核间距离的数值最接近于?
A? 4.0×10-8cm?B? 3.5×10-8cm
C? 3.0×10-8cm?D? 5.0×10-8cm
参考答案:A
本题解析:摩尔质量除以阿伏加德罗常数,再除以2,得到每个氯化钠分子质量;
由于氯化钠晶体近似为正方体,每个分子质量除以密度得到每个分子体积,开3次方得到晶体边长;
由于氯化钠晶体的原子排列,钠原子间隔为根号2倍边长,于是最后算出答案为3.9*10-8,近似为4.0*10-8;
本题难度:简单
4、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
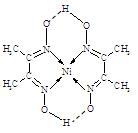
参考答案:(1)>(2分)
(2)TiN>MgO>CaO>KCl(2分,有1项排错即给0分)? 12(2分)
(3)CrO2(2分)
(4)sp2(2分)?[Ar]3d74s2(2分)
本题解析:略
本题难度:一般
5、填空题 (16分)观察下列部分图形,并按要求回答下列问题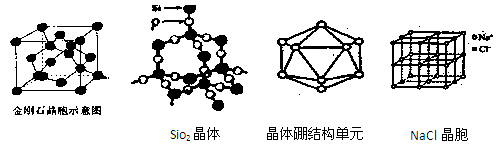
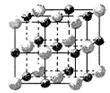
(1)由金刚石晶体结构和晶胞图知,金刚石是原子晶体,晶体中碳原子取?
杂化轨道形成σ键,每个晶胞中含碳原子数为?个。
(2)白磷分子(P4)中键角为?,分子的空间结构为?,每1mol白磷分子含?mol P-P共价键。若将1分子白磷中所有P-P键打开并各插入一个氧原子所得氧化物的分子式为?,若每个P原子的孤对电子再与氧原子配位,就可得到磷的另一种氧化物?(填分子式)。
(3)由SiO2晶体结构知SiO2晶体是?晶体,每1mol SiO2晶体含?mol Si-O共价键。
(4)已知CaC2晶体的晶胞结构与NaCl晶体相似,(如图)但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,则CaC2晶体中Ca2+配位数(C.N)为?。C22-与O22+互为等电子体,O22+的电子式为?,1molO22+中含π键数目为?。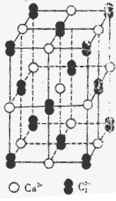
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,观察图形回答。这个基本结构单元由?个硼原子组成,共含有?个B-B键。
(6)若测得mg NaCl固体的体积为Vcm3,已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则阿佛加德罗常数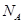 的表达式为?。
的表达式为?。
参考答案:(16分)(1)SP3,???8?。
(2)60°, ?正四面体,6 ,?P4O6,???P4O10? .
(3)原子,? 4。
(4)? 4 ?、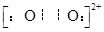 ??、? 2NA个?。
??、? 2NA个?。
(5)? 12?、 30??。
(6)?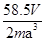 ?。(除(6)2分,其余每空1分)
?。(除(6)2分,其余每空1分)
本题解析:略
本题难度:一般