时间:2017-08-01 02:29:12
1、填空题 纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 离能(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
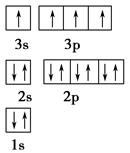
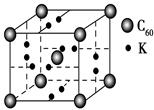
参考答案:(1)能量最低原理 (2)sp杂化 (3)否 C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
(4)4s1 3︰1 (5)N>C>Si 正四面体 30
本题解析:(1)E(3s)<E(3p),3s轨道排满才能排3p;(2)由表格电离能可推测出A是Be,B是Mg,BeCl2中心原子的价层电子对数为2,采取sp杂化;(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同;(4)K原子序数为19,价电子为4s1,从晶胞可看出C60的个数8×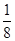 ?+1=2,K原子的个数12×
?+1=2,K原子的个数12×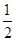 ?=6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)×
?=6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)×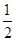 =30。
=30。
本题难度:困难
2、选择题 下列物质中,有共价键的单质是
[? ]
A.N2
B.CH4
C.NaCl
D.MgCl2
参考答案:A
本题解析:
本题难度:简单
3、选择题 短周期元素X、Y、Z,它们的原子最外层电子数依次为1、6、6,Z位于Y的上一周期,则X、Y、Z三种元素形成的某种化合物的化学式可能为( )
A.XY2Z3
B.X2YZ4
C.X3YZ4
D.X3YZ3
参考答案:短周期元素X、Y、Z,它们的原子最外层电子数依次为1、6、6,则X处于ⅠA族,Y、Z处于ⅥA,Z位于Y的上一周期,则Z为氧元素,Y为硫元素.X为+1价,Y、Z可以形成SO32-,SO42-.所以X、Y、Z三种元素形成的某种化合物的化学式可能为X2YZ3、X2YZ4.
故选B.
本题解析:
本题难度:一般
4、简答题 以下是元素周期表的一部分,回答下列有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ 4 ⑩ (11) (12) |
参考答案:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,(11)为Ca,(12)为Br,
(1)⑥为硅,元素符号为Si,Cl的质子数为17,容易得到1个电子变为离子,离子结构示意图为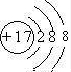
,F2的电子式为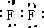
,氨气的结构式为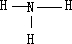
,
故答案为:Si;
;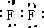
;
;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,故答案为:Ar;
(3)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;?
(4)电子层越多,半径越大,同一周期,从左到右半径在减小,则K的原子半径最大,故答案为:K;
(5)KOH为碱性最强的碱,Al(OH)3为两性氢氧化物,恰好反应的离子方程式为Al(OH)3+OH?-=AlO2?-+2H2O,故答案为:Al(OH)3+OH?-=AlO2?-+2H2O.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是?
A.构成单质分子的微粒一定含有共价键
B.熔融时能导电的化合物,一定是离子化合物
C.水加热至1000℃也不分解,是由于水分子间存在氢键
D.由H原子形成1molH-H键所要吸收的能量就等于H-H的键能
参考答案:B
本题解析:A、稀有气体的单质中不存在任何化学键,错误;B、共价化合物熔融时仍为分子或原子状态,不存在自由移动的离子,所以熔融时能导电的化合物,一定是离子化合物,正确;C、水难分解是因为水分子中的H-O键强度大,错误;D、成键时放出能量,断键时吸收能量,错误,答案选B。
本题难度:一般