时间:2017-07-27 09:11:13
1、实验题 甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)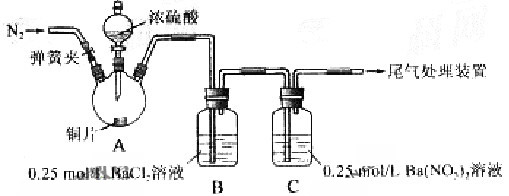
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中  产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | ? ___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
2、选择题 某探究小组用洗净的废铜屑制备硝酸铜,下列方案中既节约原料又环保的是
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
D.Cu  CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
3、实验题 (16分)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其发扬进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaoH=_____________。
(2)反应Cl2+Na2SO3+2NaOH="2NaCl" + Na2SO4 +H2O中的还原剂为______________________-。
(3)吸收尾气一段时间后,吸收液(强碱性)吵肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32- 假设2:既不存在SO32-也不存在ClO-
假设2:既不存在SO32-也不存在ClO-
假设3:_______ ______
______
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 | |||||||||||||||
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |  | |||||||||||||||
| 步骤2: | ? | |||||||||||||||
| 步骤3: | ? 4、填空题 室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。 5、实验题 (16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为
|