时间:2017-07-27 09:11:13
1、实验题 同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物。
回答下列问题:
(1)装置B的作用___________________________________________________。
装置D除了吸收过量的SO2外还有什么作用___________________________。
(2)如何检验反应中是否有O2生成______________________________________。
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4.
该方案是否合理____________(填是或否),理由是_____________________-。
参考答案:(1)干燥SO2气体,防止较多的水蒸气与Na2O2反应。
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;
(2)用带有余烬的木条靠近干燥管口a,观察其是否燃烧。?
(3)否;HNO3有氧化性,据此不能确定产物是NaSO3还是Na2SO4或者二者兼有
本题解析:(1)A中生成的SO2中含有水蒸气,而水也能与过氧化钠反应,所以需要除去SO2中的水。由于空气中也含有水蒸气和CO2。因此为防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,需要用碱石灰来吸收。
(2)检验氧气一般用带火星的木条靠近干燥管口a,木条复燃即证明有氧气生成。
(3)由于硝酸具有氧化性,可以把溶液亚硫酸钡氧化生成硫酸钡,所以据此不能确定产物是NaSO3还是Na2SO4或者二者兼有。
本题难度:一般
2、实验题 某研究性学习小组进行溴乙烷的制备及性质探究实验。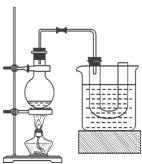
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A.氢氧化钠稀溶液
B.碳酸钠稀溶液
C.硝酸银溶液
D.四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图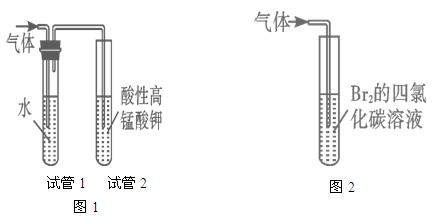
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
参考答案:(1)防止乙醇挥发
(2)2HBr+H2SO4(浓) ? Br2+SO2↑+2H2O
? Br2+SO2↑+2H2O
[或2NaBr+3H2SO4(浓)  ?Br2+SO2↑+2NaHSO4+2H2O];
?Br2+SO2↑+2NaHSO4+2H2O];
Br2+H2O=HBrO+HBr
(3)水浴加热
(4)上层;? B
(5)除去乙醇蒸气;CH2=CH2 + Br2 CH2BrCH2Br
CH2BrCH2Br
本题解析:略
本题难度:一般
3、填空题 有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下: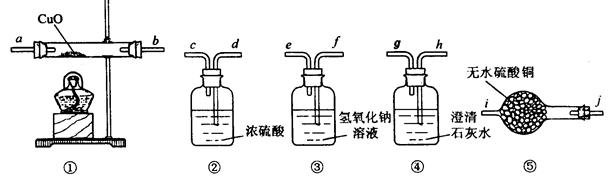
 (1)实验时,导管接口的顺序是?。
(1)实验时,导管接口的顺序是?。
(2)装置①内发生反应的化学方程式是?(任写一个,并标出电子转移方向和数目)。
(3)证明混合气体中含有氢气的实验现象是? ?。(4)证明混合气体中含有CO的实验现象是?。
?。(4)证明混合气体中含有CO的实验现象是?。
参考答案:⑴? f e d c a b? j i h g? ⑵ CO + CuO ═ Cu + CO2 ?或 H2 + CuO ═ Cu + H2O
⑶ ⑤中的无水硫酸铜变蓝(4)④中出现浑浊
本题解析:略
本题难度:简单
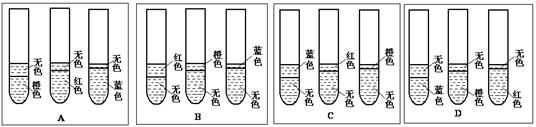
4、实验题 (5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同 的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
参考答案:(5分)
(1)A?(1分)
(2)高温下乙酸乙酯挥发 (1分)?
(3) 乙酸乙酯在水溶液中形成乳浊液?(1分)
(4)有机层和水层接触面太小(1分)
(5)乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。(1分)
本题解析:(1)实验1中的乙酸乙酯不水解,所以下层仍是橙色,上层为无色的乙酸乙酯;实验2中加入稀硫酸,乙酸乙酯水解后的溶液呈酸性,酸使甲基橙变红色,所以下层是红色,上层是无色;实验3加入氢氧化钠,乙酸乙酯水解后的溶液呈碱性,所以碱遇石蕊变蓝色,下层是蓝色,上层是无色,答案选A。
(2)乙酸乙酯的沸点较低,温度过高,造成乙酸乙酯的挥发损失;
(3)乙酸乙酯微溶于水,振荡后形成乳浊液使溶液显浑浊;
(4)乙酸乙酯微溶于水,所以有机层和水层接触面太小,反应速率慢;
(5)改进的实验与原来相比,差别在于加入了饱和食盐水,说明乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。
本题难度:一般
5、填空题 (14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法来制备KMnO4。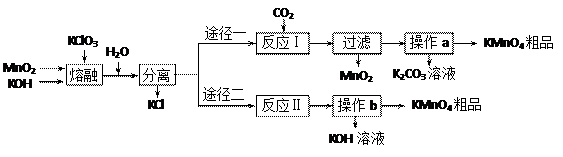 已知:①3MnO2+KClO3+6KOH
已知:①3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
②几种物质的溶解度:
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
 ⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为?▲?;该反应中可以循环利用的产物是?▲?。
⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为?▲?;该反应中可以循环利用的产物是?▲?。参考答案:⑴CD
⑵2:1? MnO2
⑶2K2MnO4+2H2O 2KOH+2KMnO4+H2↑
2KOH+2KMnO4+H2↑
⑷蒸发浓缩、降温结晶
⑸①18.9g?②滴定时消耗草酸溶液的体积、KMnO4粗品的质量
本题解析:略
本题难度:一般