时间:2017-07-27 08:48:40
1、选择题 向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
A.溶液的pH增大
B.溶液的pH减小
C.溶液中Ca2+浓度保持不变
D.溶液中Ca2+物质的量保持不变
参考答案:C
本题解析:
正确答案:C
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况,发生CaO+H2O=Ca(OH)2 ,溶液中水减少,Ca(OH)2减少析出,溶液仍饱和。A、B应为溶液的pH不变;D.溶液中Ca2+物质的量应减少。
本题难度:简单
2、选择题 下列说法正确的是
[? ]
参考答案:D
本题解析:
本题难度:简单
3、选择题 已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是
A.1.36×10-5 mol·L-1
B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1
D.1×10-5 mol·L-1
参考答案:B
本题解析:此时溶液中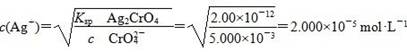
故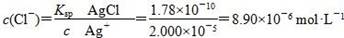 。
。
本题难度:一般
4、选择题 下列说法中,正确的是
A.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)<Ksp(AgI)
B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大
D.强电解质的水溶液中不存在分子
参考答案:B
本题解析:A、沉淀易向更难溶的方向转化,AgCl 悬浊液中加入 KI 稀溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)>Ksp(AgI) ,错误;B、水的离子积常数影响因素为温度,在纯水中加入强碱溶液,温度不变,水的离子积常数不变,正确;C、氢氧化钙的溶解度随温度的升高而降低,饱和石灰水中加入一定量生石灰,温度明显升高,氢氧化钙溶液的浓度降低,所得溶液的氢氧根浓度减小, pH 减小,错误;D、强电解质的水溶液中全部电离,水溶液中不存在强电解质分子,但存在溶剂水分子,错误。
考点:考查溶液中离子平衡。
本题难度:一般
5、计算题 硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为
200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
参考答案:(1)c(Ag+)= ×2=0.0536mol/L
×2=0.0536mol/L
(2)因为Ag2SO4固体过量,该溶液仍为Ag2SO4饱和溶液,所以c(Ag+)=0.0536mol/L
(3)设加入的BaCl2溶液的体积为VL, ×2=0.0200mol/L,V=0.489L。
×2=0.0200mol/L,V=0.489L。
本题解析:
本题难度:一般