时间:2017-07-27 08:48:40
1、选择题 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI> Ag2CrO4
B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
参考答案:C
本题解析:在饱和AgCl溶液中,c(Ag+)= =1.34×10—5 mol/L;
=1.34×10—5 mol/L;
在饱和AgI溶液中,c(Ag+)= =1.23×10—8 mol/L;
=1.23×10—8 mol/L;
在饱和Ag2CrO4溶液中,c(Ag+)= =1.59×10—4mol/L
=1.59×10—4mol/L
故答案为C
本题难度:一般
2、选择题 已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。 
滴定时,你认为该滴定适宜选用的指示剂是
[? ]
A.KBr
B.KI
C.K2S
D.K2CrO4
参考答案:D
本题解析:
本题难度:一般
3、填空题 (共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
?。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示):?;?;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
?。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入?,目的是?;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
?。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) 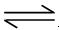 ?Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
?Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是?(填写序号);②中氯离子的浓度为?mol·L-1
参考答案:(1)c(NH4+)> cSO42-)> c(H+)> c(OH-)
(2)HCO3- +H2O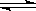 ? H2CO3+OH-? HCO3-
? H2CO3+OH-? HCO3-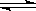 ?H+ +CO32-
?H+ +CO32-
在溶液中HCO3-的水解程度大于电离程度,所以溶液呈碱性.
(3)HCl溶液?抑制Fe3+的水解,防止溶液变质.
Fe3+ +3HCO3-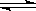 ?Fe(OH)3↓+3CO2↑(4)②>①>④>③? 9×10-10
?Fe(OH)3↓+3CO2↑(4)②>①>④>③? 9×10-10
本题解析:略
本题难度:简单
4、选择题 石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq) +2OH-(aq),加入少量下列固体物质,可使Ca(OH)2减少的是
Ca2+(aq) +2OH-(aq),加入少量下列固体物质,可使Ca(OH)2减少的是
[? ]
A. Na2CO3
B. NaCl
C. NaOH
D. CaCl2
参考答案:A
本题解析:
本题难度:一般
5、简答题 过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为______;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁.若加碱前溶液中c(Mg2+)=0.056mol?L-1,那么需调节溶液的pH=______时,才开始出现沉淀.[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在
70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如右图所示,则T3时所得晶体的化学式为______.(书写简单计算过程)
(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数______(填“升高”、“降低”或“不变”).
参考答案:(1)根据已知可写出反应物和部分生成物:
Na2B4O7+NaOH→NaBO2+?,根据质量守恒可知未知物为H2O,
配平后方程式为:Na2B4O7+2NaOH═4NaBO2+H2O,离子方程式为:
B4O72-+2OH-=4BO2-+H2O.
故答案为:B4O72-+2OH-=4BO2-+H2O.
(2)Mg2+沉淀的PH计算如下:Ksp═c(Mg2+)×c(OH-)2 ,设c(OH-)浓度为x,带入Ksp表达式得:
0.056×x2═5.6×10-12,解得x═1.0×10-5,C(H+)=1×10-14÷1.0×10-5═1×10-9,pH═9.故调节溶液的pH=9时,才开始出现沉淀.
故答案为:9.
(3)计算过程:T3时,nNa=(20.0g×23%)/23g.mol-1=0.2mol?
则30.8g样品中,nNa:nB:nH:nO=0.2:0.2:0.2n:1.4
有:0.2×23+0.2×11+0.2n+1.4×16=30.8
解出n=8,则原晶体为:NaBO3?4H2O.
进一步根据T3时所得晶体中钠元素的质量分数,求出结晶水数目:23÷(23+11+48+18n)═0.23,解得n═1.
所以T3时所得晶体的化学式为NaBO3?H2O.
故答案为:NaBO3?H2O?
(4)比较化学式NaBO3?H2O、NaBO2 可知,NaBO2 中钠的质量分数大于NaBO3?H2O?中钠的质量分数.所以过硼酸钠晶体中混有NaBO2,则产品中钠的质量分升高.
故答案为:升高.
本题解析:
本题难度:一般