时间:2017-07-18 02:34:05
1、选择题 共价键的断裂有均裂和异裂两种方式,即均裂: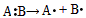 ,异裂:
,异裂: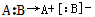 。下列化学反应中发生共价键均裂的是
。下列化学反应中发生共价键均裂的是
[? ]
A. 2K+2H2O=2KOH+H2↑
B. 2Na+2C2H5OH→2C2H5ONa+H2↑
C.?Na2CO3+ H2O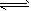 NaHCO3 + NaOH
NaHCO3 + NaOH
D. CH3COOH +C2H5OH H2O+CH3COOC2H5
H2O+CH3COOC2H5
参考答案:D
本题解析:
本题难度:简单
2、选择题 经X射线研究证明:PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成。下列关于PCl5的推断正确的是(?)
A? PCl5固体是分子晶体
B? PCl5固体有良好的导电性
C? PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D? PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
参考答案:C
本题解析:PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成,所以应该是离子晶体,但在固态时不能导电,AB不正确。根据空间构形可判断,C正确,D是错误的,答案选C。
本题难度:一般
3、填空题 (14分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。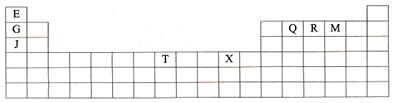
(1)T3+的核外电子排布式是:?
(2)Q、R、M的第一电离能由大到小的顺序是?(用元素符号表示)
(3)根据下列说法填空:
①G单质的熔点高于J单质,是因为?
②将J2M2溶于水,要破坏?(离子键、极性共价键、非极性共价键)
③RE3沸点高于QE4,是因为?
④一个Q2E4分子中E的?轨道与Q的?轨道形成σ键。
(4)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 ??(填G或R的元素符号)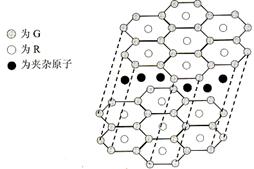
参考答案:(1)[Ar]3d5(2)N>O>C
(3)①锂的金属键大于钠
②?离子键和非极性共价键③氨分子间有氢键,而甲烷分子间没有氢键④1S轨道、SP2杂化轨道(各1分)(4)Li
本题解析:根据元素在周期表中的位置可知,E是H、G是Li、J是Na、Q是C、R是N、M是O、T是Fe、X是Cu。
(1)半充满是稳定性强,所以根据构造原理可知Fe3+的核外电子排布式是[Ar]3d5。
(2)非金属性越强,第一电离能越大。N原子中3p电子属于半充满,稳定性强,所以第一电离能最大,所以第一电离能由大到小的顺序是N>O>C。
(3)①Li和Na均是金属晶体,但离子半径是锂的小于钠的,因此金属键强,熔点高。
②过氧化钠是离子化合物,含有离子键和非极性键。
③氨气分子中存在氢键,所以沸点高于甲烷的。
④在化合物乙烯中氢原子的1s轨道与同一种的sp2杂化轨道形成σ键。
(4)平面六边形的每一个顶点被周围的3各六边形共用,所以1个六边形含有的Li是6×1/3=2。N原子在中间,完全属于该六边形。因为化学式为Li3N,所以中间夹杂的是Li。
本题难度:一般
4、选择题 下列的晶体中,化学键种类相同,晶体类型也相同的是?
[? ]
A .SO2与SiO2?
B.CO2与H2O?
C.NaCl与HCl?
D.CCl4与KCl
参考答案:B
本题解析:
本题难度:简单
5、简答题 已知四种短周期元素W、X、Y、Z的原子序数依次增大,请结合表中信息回答下列问题:
W
X
Y
Z
结构或性质
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物
焰色反应呈黄色
在同周期主族元素形成的简单离子中,离子半径最小
最高正化合价与最低负化合价之和为零
(1)Z在元素周期表中位于______族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是______(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是______(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:______,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸的相当.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是______,混合后溶液中离子的浓度由大到小的顺序是______.
参考答案:四种短周期元素W、X、Y、Z的原子序数依次增大,W元素最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为氮元素;X焰色反应呈黄色,则X为Na元素;Y原子序数大于Na元素,处于第三周期,在同周期主族元素形成的简单离子中,离子半径最小,故Y为Al元素;Z的最高正化合价与最低负化合价之和为零,处于ⅣA族,原子序数大于Al元素,则Z为Si元素
(1)Z为Si元素,处于周期表中第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)氢氧化钠与硝酸、硅酸、氢氧化铝都能发生反应,故答案为:Na;
(3)①a.自然界中的含量多少与非金属性无关,故a错误;
b.氯化物水溶液的酸性越强,则金属元素的最高价氧化物对应水化物的碱性越弱,金属性越弱,故b正确;pH
c.金属与酸或水反应越容易,金属性越强,故c正确;的难易程度
d.金属性强弱与失去电子数多少无关,与难易程度有关,如Al失去3个电子,Na失去1个电子,但金属性Na>Al,故d错误;
故选bc;
②原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,Na的金属性更强,
故答案为:原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,方程式为:HN3+NaOH=NaN3+H2O,等体积、等浓度,二者恰好反应,为NaN3溶液,NaN3溶液中N3-水解,溶液呈碱性,故溶液中离子浓度c(Na+)>c(N3-)>c(OH-)>c(H+),
故答案为:HN3+NaOH=NaN3+H2O;c(Na+)>c(N3-)>c(OH-)>c(H+).
本题解析:
本题难度:一般