时间:2017-07-18 01:09:58
1、填空题 健康人血液中的pH保持在一定范围内变化,这是因为血液中存在如下平衡:H2CO3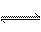
 +H+,医学上称为血液酸碱平衡,试解答下列问题:
+H+,医学上称为血液酸碱平衡,试解答下列问题:
(1)蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分为HCOOH)的有机酸,HCOOH同CH3COOH一样是一种有机弱酸,写出HCOOH在溶液中电离的方程式:___________________________________。
(2)当人受到蚂蚁叮咬时皮肤上常起小疱,这是因为人体血液中酸碱平衡被破坏所致,若不看医生治疗,过一段时间小疱也会自行痊愈,这是由于血液中又恢复了原先的酸碱平衡,试用平衡移动原理解释上述事实:_____________________________________________________。
参考答案:(1)HCOOH H++HCOO-
H++HCOO-
(2)因血液中存在如下平衡,H2CO3
 +H+,当注入HCOOH时上述平衡体系中的c(H+)增大,pH变小,由于H2CO3和
+H+,当注入HCOOH时上述平衡体系中的c(H+)增大,pH变小,由于H2CO3和 相互调节使平衡发生移动,过一段时间可恢复原先的状态
相互调节使平衡发生移动,过一段时间可恢复原先的状态
本题解析:本题结合人体血液中的酸碱度变化和电解的知识进行命题,充分考查了学生综合运用知识的能力和对知识的创新应用能力。本题给出了H2CO3
 +H+平衡体系存在于血液中,同时又向其中加入另一种酸性物质,将会对原先的平衡体系有影响,但由于平衡移动的原因,这种影响不会长期存在。
+H+平衡体系存在于血液中,同时又向其中加入另一种酸性物质,将会对原先的平衡体系有影响,但由于平衡移动的原因,这种影响不会长期存在。
本题难度:简单
2、选择题 下列事实一定能说明HNO2为弱电解质的句数是
①常温时NaNO2溶液的pH大于7;
②用HNO2溶液做导电实验,灯泡很暗;
③HNO2与NaCl不能反应;
④常温下0.1 mol·L-1的HNO2溶液pH=2;
⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2;
⑥1 L pH=1的HNO2溶液和1 L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多;
⑦HNO2溶液中加入一定量的NaNO2晶体,溶液中c(OH-)增大;
⑧HNO2溶液中加水稀释,溶液中c(OH-)增大。
A.4句
B.5句
C.6句
D.7句
参考答案:B
本题解析:①常温下NaNO2溶液,根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,如果NaNO2是强酸强碱盐,PH=7,而题干中PH>7,说明NaNO2为强碱弱酸盐,故①正确;②溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HNO2是弱电解质,故错误;③HNO2与NaCl不能反应,无论亚硝酸是强酸还是弱酸,它们间都不反应,故③错误;④常温下,0.1mol/L的HNO2溶液的pH为2,说明亚硝酸只有部分电离,所以能说明是弱酸,故正确;⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2,pH<4,说明 亚硝酸中存在电离平衡,所以能说明是弱酸,故正确;
考点:强电解质和弱电解质的概念
本题难度:一般
3、填空题 已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为?;
(2) 若NaHA溶液显碱性,则H2A是?(填“强酸”、“弱酸”或“无法确定”),原因是?。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是?;
a.c(H+)·c(OH-)=1×10-14? b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+)? d.c(Na+)=c(HA-)+c(A2-)
参考答案:
(1)H2A H++HA-,HA-
H++HA-,HA- ?H++A2-(2分)
?H++A2-(2分)
(2)弱酸(1分)HA?-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(2分)
(3)a(2分) ;
本题解析:(1)多元弱酸部分电离,分步书写。(2)若NaHA溶液显碱性, 说明HA?-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(3)在25℃下,任何溶液一定存在c(H+)·c(OH-)=1×10-14,故a正确;滴加到溶液刚好反应时,生成Na2A和K2A,溶液呈碱性,要成中性必须NaHA过量,故b错、C错;根据物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),故d错。
本题难度:简单
4、选择题 25℃时,几种弱酸的电离常数如下:
| ? 弱酸的化学式 | ? CH3COOH | ? HCN | ? H2S ? 电离常数(25℃) ? 1.8×10-5 ? 4.9×10-10 ? K1=1.3×10-7 K2=7.1×10-15 |
参考答案:C
本题解析:
本题难度:简单
5、选择题 由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7?K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2?K2=1.02×10-7 |
参考答案:B
本题解析:弱酸的电离平衡常数越大,酸性越强。根据电离平衡常数可知,酸性强弱顺序是H2SO3>HC2O3>HSO3->HCO3-,所以根据较强的酸制备减弱的酸可知,A、C、D均是正确的,B不正确,即HSO3-不能制备碳酸,答案选B。
本题难度:一般