时间:2017-07-18 01:09:58
1、选择题 下列溶液中加入少量NaOH固体导电能力变化不大的是
A.盐酸
B.CH3COOH
C.NH3·H2O
D.H2O
参考答案:A
本题解析:溶液的导电能力与自由移动离子浓度及所带电荷有关:
A:H++OH-=H2O,自由移动离子H+由Na+代替,导电性无变化
B:CH3COOH+OH-=CH3COO-+H2O:弱电解质转化为强电解质溶液,导电性增强
C:弱电解质溶液中增加了强电解质,导电性增强
D:水为弱电解质,加入NaOH后,自由移动离子浓度增大,导电性增强
答案为A
本题难度:一般
2、选择题 区分强电解质和弱电解质的依据是?
A.溶解度的大小
B.属于离子化合物还是共价化合物
C.在水溶液中是否存在电离平衡
D.溶液导电性的强弱
参考答案:C
本题解析:弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质,据此可知选项C正确,答案选C。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确弱电解质的含义以与强电解质的判断依据,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
3、选择题 下列关于稀HAc溶液叙述正确的是
A.加热后,HAc的电离程度减小
B.加水稀释后,溶液的酸性增强
C.加入NaAc固体后,HAc的电离程度减小
D.加入少量并醋酸后,溶液的酸性减弱
参考答案:C
本题解析:
答案:C
A.不正确,加热后,HAc的电离程度变大
B.不正确,加水稀释后,溶液的酸性减弱
C.正确,加入NaAc固体后,AC―浓度增大,HAc的电离程度减小
D.不正确,加入少量并醋酸后,溶液的酸性减弱
本题难度:一般
4、选择题 常温下,将0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,pH大于7,若混合后溶液体积等于两溶液体积之和,则下列关系中正确的是
A.[HA]<[A-]
B.[HA]一定大于0.1 mol·L-1
C.[Na+]=[HA]+[A-]
D.2[OH-]=2[H+]+[HA]-[A-]
参考答案:D
本题解析:0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,生成等物质的量的NaA、HA;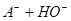

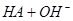 ,
,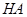

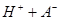 ;pH大于7,说明水解大于电离,所以[HA]>[A-] ,故A错误;[HA]一定大于0.05 mol·L-1 ,故B错误;根据物料守恒,2[Na+]="[HA]+[A-]" ,故C错误; 根据电荷守恒和物料守恒,2[OH-]=2[H+]+[HA]-[A-],故D正确。
;pH大于7,说明水解大于电离,所以[HA]>[A-] ,故A错误;[HA]一定大于0.05 mol·L-1 ,故B错误;根据物料守恒,2[Na+]="[HA]+[A-]" ,故C错误; 根据电荷守恒和物料守恒,2[OH-]=2[H+]+[HA]-[A-],故D正确。
考点:本题考查弱电解质电离和盐的水解。
本题难度:一般
5、选择题
A.A>B
B.A=10-4 B
C.B=10-4A
D.A=B
参考答案:B
本题解析:本题有两种解法。
方法1(常规解法):NaOH(aq)中:
c水(OH-)=c水(H+)=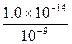 mol·L-1=1.0×10-5 mol·L-1
mol·L-1=1.0×10-5 mol·L-1
CH3COONa(aq)中:
c′水(OH-)=c′总(OH-)=10-9 mol·L-1
则A∶B=10-4
方法2(巧解法):NaOH(aq)中,水的电离被抑制;CH3COONa(aq)中,水的电离被促进;故A<B。
本题难度:一般