时间:2017-07-18 01:09:58
1、填空题 在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.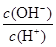
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):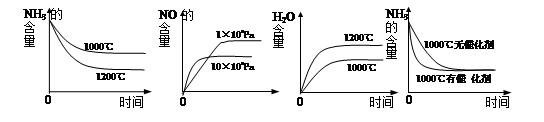
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
2、选择题 将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起(? )
A.溶液的pH增大
B.CH3COOH电离的百分率变大
C.溶液的导电能力减弱
D.溶液中c(OH-)减小
3、选择题 能说明醋酸是弱电解质的是(?)
①用浓硫酸和醋酸钠固体共热可制得醋酸 ②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢 ? ④pH=2醋酸溶液稀释1000倍后pH小于5
A.②
B.①②
C.②④
D.①③④
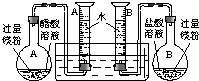
4、简答题 某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于______,其改进方法是______.
(2)改进装置后,检查一侧装置的气密性的方法是______.
(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是______.
正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 | 反应时间 A瓶 B瓶 | |
| 40mL0.1mol/L 醋酸溶液 | 40mL0.1mol/L 盐酸溶液 5mL t(a1)=155s t(b1)=7s 10mL t(a2)=310s t(b2)=16s 15mL t(a3)=465s t(b3)=30s 20mL t(a4)=565s t(b4)=64s … … … 44.8mL t(an)=865s t(bn)=464s | |||
5、选择题 醋酸溶液中存在电离平衡:CH3COOH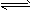 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
[? ]
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7