时间:2017-07-10 18:42:02
1、选择题 (08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H+=2AL3++3H2↑的是(铝条表面的氧化膜均已除去): ?
?
参考答案:B
本题解析:本题考查原电池和电解池,较难题。A为原电池,总反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑;C为原电池,总反应为:Al+4H++NO3-=Al3++NO↑+2H2O;D项为电解池,总反应为:2H2O=2H2↑+O2↑。
本题难度:一般
2、选择题 某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
A.甲装置是原电池,乙装置是电解池
B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g
C.实验一段时间后,甲烧杯中溶液的pH增大
D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置
参考答案:D
本题解析:A、锌与稀硫酸反应生成硫酸锌与氢气,属于自发的氧化还原反应,即甲装置是原电池,其中锌是负极,铜是正极。乙装置是电解池,其中碳棒是阴极,Pt电极是阳极,A正确;B、甲中产生的气体是氢气,0.1mol氢气转移0.2mol电子,则依据电子守恒可知乙装置中析出铜的物质的量是0.1mol,质量是6.4g,B正确;C、甲装置中氢离子放电,溶液的酸性降低,因此实验一段时间后,甲烧杯中溶液的pH增大,C正确;D、乙装置中碳棒是阴极,因此将乙中的C电极换成铜电极,乙装置不能变成电镀装置,因为电镀装置中镀层金属应该作阳极,D不正确,答案选D。
本题难度:简单
3、选择题 从理论上分析,关于Fe—CuSO4溶液—Cu原电池的叙述正确的是
A.铜极为负极
B.电子从铜沿导线转移到铁
C.铁表面析出金属铜
D.总反应为Fe + CuSO4 = FeSO4 + Cu
参考答案:D
本题解析:略
本题难度:简单
4、填空题 人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式: 。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
参考答案:(16分)
(1) Pb+SO42-
本题解析:
本题难度:一般
5、填空题 (1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为__________________,负极的电极反应式为__________________,原电池的总反应是__________________;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为________,转移的电子数为__________摩尔,溶液的酸性________(填“增强”或“减弱”)。
(2)选用下列试剂和仪器设计一个原电池。画出装置图。标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应。试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液。仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
__________________________
参考答案:(1)正极:2H++2e-=H2↑;负极:Zn-2e-=Zn2+;总反应:Zn+2H+=Zn2++H2↑;2.24L;0.2;减弱(2)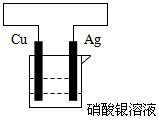
正极为Ag,负极为Cu,电解质溶液为硝酸银溶液
负极:Cu -2e-= Cu2+
正极:2Ag++2e-=2Ag
(答案合理即可)
本题解析:
本题难度:一般