时间:2017-07-10 18:42:02
1、选择题 目前已研制成功多种锂电池。某种锂电池的总反应式为Li+MnO2=LiMnO2,下列说法正确的是(? )。
A.Li是正极,电极反应为Li-e-=Li+
B.Li是负极,电极反应为Li-e-=Li+
C.Li是负极,电极反应为MnO2+e-=Mn
D.Li是负极,电极反应为Li-2e-=Li2+
参考答案:B
本题解析:本题根据总反应式判断Li被氧化,为负极材料,失去电子成为Li+,正极放电的为MnO2,若已知电池总反应式而要写电极反应式,这类题的一般处理方法是:根据“负失氧、正得还”的规律先判断出负极材料,负极材料若是金属,则失电子而变为相应阳离子(注意:Fe失电子应变为Fe2+),负极材料若是其他被氧化的物质(如氢氧燃料电池中的H2、甲烷燃料电池中的CH4),则失电子变为相应氧化产物,然后再推断正极反应。
本题难度:一般
2、填空题 以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极反应式是______负极反应式是______.
参考答案:根据电极材料的活泼性知,锌为负极,石墨为正极;原电池中,负极失电子变成离子进入溶液;正极上,溶液中的铜离子得电子生成铜;所以正负极上的电极反应分别为:
(+)Cu2++2e-=Cu (-)Zn-2e-=Zn2+
故答案为:(+)Cu2++2e-=Cu;
(-)Zn-2e-=Zn2+.
本题解析:
本题难度:一般
3、填空题 (12分)按下图装置进行实验,并回答下列问题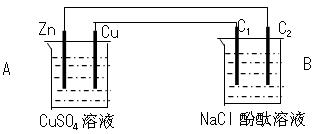
(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________?__________
(3)石墨棒C1为______极,电极反应式为__________?_____________
石墨棒C2附近发生的实验现象为________________?____________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
参考答案:(12分)
(1)原电池,电解池
(2)负? Zn - 2e- = Zn2+?(3)阳? 2 Cl- - 2e- = Cl2↑
电极上有气泡产生,无色溶液变红色?(4)0.65
本题解析:略
本题难度:简单
4、选择题 如图所示,下列有关叙述正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.锌是正极
D.氢离子被还原
参考答案:A、该原电池中铜作正极,正极上氢离子得电子生成氢气,所以铜片上有气泡生成,故A错误;
B、该原电池中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C、该原电池中锌作负极,故C错误;
D、该原电池中铜作正极,正极上氢离子得电子被还原,故D正确.
故选D.
本题解析:
本题难度:简单
5、计算题 (9分)将铜片、锌片和250mL稀硫酸组成原电池,当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全。
(1)该原电池的负极反应式为
(2)原稀硫 酸的物质的量浓度是 mol·L-1
酸的物质的量浓度是 mol·L-1
(3)列式计算锌片减少 的质量。
的质量。
参考答案:(1)
(2)1.2
(3)
本题解析:略
本题难度:一般