时间:2017-07-10 17:40:16
1、选择题 下列物质与氢氧化钠溶液反应,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色的是
A. NH3
B.FeCl3溶液
C. FeCl2溶液
D. NaHCO3溶液
参考答案:C
本题解析:题中所示的反应现象是往含有Fe2+的溶液中滴加碱溶液时发生的现象,故选C。2+的性质
点评:本题考查的是有关Fe2+的性质,考查的知识源自于教材,旨在考查对基础知识的识记,注意基础知识的积累掌握。
本题难度:一般
2、选择题 甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是
下列说法正确的是
A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
B.若甲为金属单质,乙为非金属单质,则甲只能是Mg
C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
参考答案:C
本题解析:A. 若甲是Al、Fe单质,丙是Fe2O3,则丁是Al2O3所属的物质类别是两性氧化物。错误。B 若甲为金属Fe,丙是H2O,乙为非金属单质H2,则丁是Fe3O4。错误。C.2C+SiO2 2CO↑+Si。正确。D若甲、乙元素是同周期元素,则该反应的化学方程式也可以为:Zn +CuO
2CO↑+Si。正确。D若甲、乙元素是同周期元素,则该反应的化学方程式也可以为:Zn +CuO ZnO + Cu.。错误。
ZnO + Cu.。错误。
本题难度:一般
3、计算题 (6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
参考答案:(1)80%?(2)2.5mol/L
本题解析:(1)根据表中数据可知,最后剩余铜2 g,则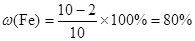
(2) Fe? +? H2SO4? =" Fe" SO4 + H2↑
56g? 1mol
2.8g?c(H2SO4)×0.02L
所用硫酸溶液溶质的物质的量浓度c (H2SO4)=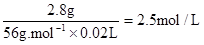
点评:本题主要考查学生的分析能力,很简单基础。
本题难度:一般
4、选择题 将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
A.504ml
B.168ml
C.336ml
D.224ml
参考答案:B
本题解析:672ml气体应该是NO2和NO的混合物,物质的量是0.672L÷22.4L/mol=0.03mol。通入氧气后剩余的气体一定是NO,物质的量是0.01mol。1.92g铜在反应中共失去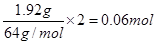 电子,则根据电子的得失守恒可知,消耗氧气的物质的量是
电子,则根据电子的得失守恒可知,消耗氧气的物质的量是 ,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
,在标准状况下的体积是0.0075mol×22.4L/mol=0.168L=168ml,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。试题基础性强,注重解题的灵活性,有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
本题难度:简单
5、填空题 (14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被?(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: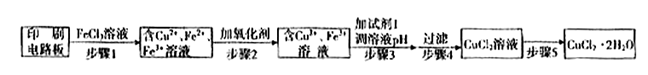 ①证明步骤I所加FeCl3溶液过量的方法是?。
①证明步骤I所加FeCl3溶液过量的方法是?。
②步骤2中所加的氧化剂最适宜的是?。
A.HNO3? B.H2O2? C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是?。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是?(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g)?△H2=-196kJ/mol
H2(g)+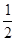 O2(g)==H2O(l)?△H3=-286kJ/mol
O2(g)==H2O(l)?△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H=?。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
参考答案:
(1)还原
(2)方法一
①取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②B
③CuO或Cu(OH)2(答案合理均给分)
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
方法二:
+64kJ/mol
(3)
本题解析:(1)两反应中铜元素化合价均降低,得电子,发生还原反应
(2)①可用KSCN溶液来检验Fe3+的存在来检验FeCl3溶液是否过量:取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②为不引入杂质,应选用双氧水,不引入任何杂质:2Fe2++H2O2+2H+=2Fe3++2H2O
③所加物质首先必须消耗H+,并且不能引入任何杂质离子,故可选用铜的氧化物或氢氧化物:CuO或Cu(OH)2
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2O Cu(OH)2+2HCl,加热时促进水解,最终得不到CuCl2·,为此可滴加浓盐酸,抑制其水解
Cu(OH)2+2HCl,加热时促进水解,最终得不到CuCl2·,为此可滴加浓盐酸,抑制其水解
方法二:依据盖斯定律①—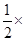 ②—③,可得:Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)?△H=+64kJ/mol
②—③,可得:Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)?△H=+64kJ/mol
(3)反应Cu+H2SO2==CuSO4+H2不可能自发进行,必须用电解池提供电能,反应中铜化合价升高,失电子,铜应该做电解池的阳极,电解质溶液为硫酸,即采用甲装置
本题难度:一般