时间:2017-07-10 17:40:16
1、选择题 向硫酸亚铁与硫酸铝的混合溶液中加入足量的浓氨水,在空气中滤出所得沉淀,经洗净、干燥、灼烧,最终得到固体的成分是( )
A.Fe2O3、A12O3
B.Fe(OH)2、Al(OH)3
C.Fe(OH)3、A1(OH)3
D.FeO、A12O3
参考答案:A
本题解析:
本题难度:简单
2、填空题 由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是?。
(2)用离子方程式表示过程②中稀硝酸的作用?,在该过程中要不断向溶液中补充盐酸,目的是?。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3?
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因?。
(4)过程ⅱ中产生FeCl2的化学方程式是?。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
参考答案:(1)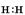 (1分)
(1分)
(2)3Fe2+ + NO3- + 4H+ ="3" Fe3+ + NO↑+ 2H2O (2分)
补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质(2分)
(3) 6SOCl2 + FeCl3?6H2O = FeCl3 + 12HCl↑+ 6SO2↑,生成的HCl会抑制FeCl3的水解,得到无水FeCl3(2分)
(4)2FeCl3 + H2?△ ?2FeCl2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl2 + H2O + O2?△ ?2FeCl3 + Fe2O3+ 2HCl(2分)
本题解析:铁和盐酸反应生成FeCl2和氢气,加入硝酸氧化为FeCl3,还有盐酸抑制Fe3+的水解,补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质,最后结晶获得晶体。
本题难度:困难
3、选择题 下列物质的转化在给定条件下能实现的是( )
①Al2O3
参考答案:A
本题解析:
本题难度:简单
4、填空题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: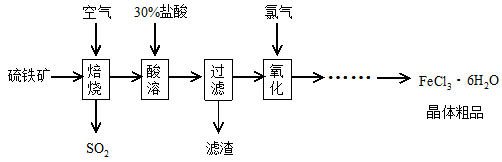
回答下列问题:
(1)焙烧硫铁矿的主要方程式为?。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、??。
(3)通氯气氧化后时,发生的主要反应的离子方程式为??;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)?。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:?。
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为?。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
2SO3(g),该反应的平衡常数表达式为K=??; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率?。
①V2O5作崔化剂?②通入过量O2?③SO2、O2进行二次氧化?④通入过量SO2
参考答案:(1)4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2?HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分)?②③(2分)
本题解析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 +? 8SO2(2分)
2 Fe2O3 +? 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是②、③。
本题难度:困难
5、选择题 将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量变轻的是 (? )
A.饱和澄清石灰水
B.稀硫酸
C.乙醇
D.食盐水
参考答案:B
本题解析:铜丝灼烧生成氧化铜,氧化铜能和稀硫酸反应生成硫酸铜和水,质量减轻。氧化铜和石灰水不反应,质量增加。氧化铜能把乙醇氧化生成乙醛,二氧化铜被还原生成铜,质量不变。氧化铜和食盐水不反应,质量增加,答案选B。
点评:该题是基础性试题的考查,试题难度不大。该题的关键是铜催化氧化乙醇的原理,有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:简单